ここから本文です
酵素を使わず、タンパク質を正しく折りたたむ新技術を開発 ~固体材料が「シャペロン」として機能する新概念を確立~
2026年02月09日
東海大学[湘南キャンパス]先進生命科学研究所 准教授の荒井堅太(理学部化学科兼務)、同理学研究科化学専攻の岩本駿平(1年次生)、および東京農工大学大学院工学研究院応用化学部門 教授の村岡貴博らで構成する研究グループは、ポリスチレン系ポリマー材料がタンパク質の立体構造形成(フォールディング)を助ける「シャペロン」として機能することを実証しました。なお、本研究成果は2月4日(水)付で米国化学会が発行する国際学術誌「JACS Au」に掲載されました。
|
<本研究成果のポイント> ◇ 固体材料が「シャペロン」として機能する新概念を実証 ◇ 酵素を用いず、酸化的フォールディングを高効率に促進 ◇ 回収・再利用可能で、HPLC精製を必要としないタンパク質製造プロセスを実現 |
■成果の概要
タンパク質は、アミノ酸の鎖が正しい立体構造へフォールディングされる(折りたたまれる)ことで本来の機能を発揮します。しかし、この過程ではタンパク質同士が塊になる「凝集」が起こりやすく、目的とする構造を得ることが難しいという課題があります。そのため、従来はプロテインジスルフィドイソメラーゼなどの酵素や、煩雑な精製工程に依存したタンパク質製造が行われてきました。本研究では、環状ジセレニド分子をポリスチレン樹脂に固定化した固体材料を設計し、この材料がタンパク質の立体構造形成を助ける「固体シャペロン」として機能することで、酵素を用いずにフォールディングをすみやかに促進できることを明らかにしました。「固体シャペロン」は、フォールディング途中で構造が未成熟なタンパク質を一時的に捕捉し、不適切な凝集を防ぎながら正しい立体構造が形成されやすい環境を与えることで、効率よくフォールディングを導きます。さらに、「固体シャペロン」は反応後に容易に回収・再利用が可能であり、複雑な精製を必要としない簡便なタンパク質製造プロセスの実現につながることが示されました。
本研究成果は、米国化学会(ACS)が発行する関連雑誌の中でも特に注目度の高い研究として「ACS Editors' Choice」に選出されました。また、研究の実施にあたり、文部科学省科学研究費助成事業による助成を受けました。
■研究の背景
タンパク質は、アミノ酸が鎖状につながったポリペプチドとして合成された後、特定の立体構造へとフォールディングすることで、生理機能を発揮します。とくに、多くの分泌タンパク質や医薬品タンパク質では、分子内に複数のジスルフィド結合*1が形成される『酸化的フォールディング*2』が不可欠です。しかし、酸化的フォールディングの途中段階にあるタンパク質は構造が未成熟で不安定なため、疎水性部位が一時的に分子表面に露出しやすく、タンパク質分子同士が互いに相互作用し、不可逆的に凝集してしまうという問題がありました。生体内では、小胞体内*3に存在するプロテインジスルフィドイソメラーゼ(PDI)*4などの酵素や分子シャペロン*5が協調的に働くことで、タンパク質の凝集*6を抑制しながら効率的なフォールディングが実現されています。一方、試験管内や工業的なタンパク質製造の現場では、このような複雑で高度に制御された環境を再現することが難しく、酵素の添加や高速液体クロマトグラフィー(HPLC)*7による目的タンパク質の精製といった工程に依存せざるを得ない状況にありました。その結果、工程数や製造コストの増大が大きな課題となっていました(図1a)。
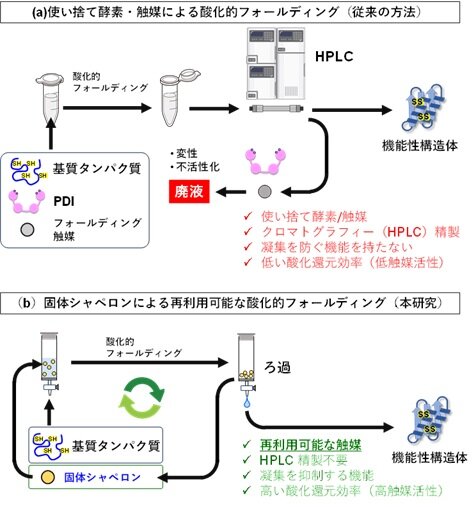
図1: 本研究のコンセプト。(a) 単回使用型の酵素および触媒に依存した、従来の酸化的フォールディングプロセス (b) 固体シャペロンを用いた、再利用可能な酸化的フォールディングプロセス。
こうした背景のもと、本研究では、非生物固体材料上に酵素が生体内で担っている「構造形成の場」を人工的に再構築することを着想し、タンパク質の酸化的フォールディングを促進する固体材料の開発を行いました。固体材料が有する「回収・再利用が可能」という特長を生かし、HPLC精製を必要とせずに繰り返し使用できる、新たなフォールディング補助材料、すなわち「固体シャペロン」という概念の構築を目指しました(図1b)。
■研究の主要成果
本研究では、PDIが担う酸化的フォールディング促進機構に着想を得て、環状ジセレニド分子*8をポリスチレン樹脂に固定化した固体材料を新たに設計しました(図2a)。今回用いたポリスチレン系固体材料は疎水性を有しているため、フォールディング途中にある構造未成熟なタンパク質の疎水性領域と相互作用することで、基質タンパク質を樹脂表面上に可逆的に一時捕捉します。この捕捉過程により、固体表面に固定化されたレドックス活性を有する環状ジセレニド分子がタンパク質分子内のジスルフィド結合形成を効果的に促進し、還元変性タンパク質(R)を正しい機能性構造体(N)へと短時間で導くことが可能となりました。実際に、モデルタンパク質を用いた検討において、PDIなどの酵素を添加しない条件下でも、酸化的フォールディングが速やかに進行し、天然構造を有するタンパク質が効率よく生成することを実証しました(図2b)。
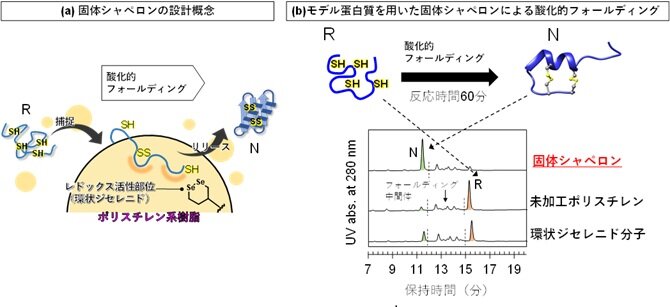
図2: 固体シャペロンの概念実証。(a)酸化的フォールディングを促進するジセレニド触媒を備えた「固体シャペロン」の設計コンセプト。疎水性相互作用により構造未成熟なタンパク質を一時的に捕捉し、樹脂表面上で適度に孤立させることで、タンパク質同士の不適切な会合(凝集)を抑制し、適切な酸化的フォールディングをすみやかに促進する。(b)モデルタンパク質の酸化的フォールディング実験から得られた試料溶液のHPLCクロマトグラム。固体シャペロンを用いた場合にのみ、機能性構造体(N)が主成分として観測された。
さらに、本固体材料が機能性構造体よりも構造未成熟なタンパク質を優先的に捕捉する傾向を示すことを実験的に明らかにしました(図3a)。その結果、タンパク質同士の不要な接触が抑制され、凝集が効果的に抑えられた状態で(図3b)、高濃度の基質タンパク質においても酸化的フォールディングが進行することが確認されました(図3c)。この挙動は、生体内においてフォールディング途中のタンパク質の凝集を抑制する分子シャペロンの働きとよく対応しており、本材料を「固体シャペロン」と呼ぶ根拠となるものです。
また、本固体材料は反応後に容易に回収でき、繰り返し使用してもフォールディング促進能が維持されることから、再利用可能なフォールディング補助材料として機能することが示されました(図4)。これにより、従来必要とされてきたHPLC精製を行うことなく、目的タンパク質を得られる簡便な製造プロセスが実現可能であることが示唆されました。これらの結果から、本材料はタンパク質の立体構造形成を助ける「固体シャペロン」として有効に機能することが明らかとなりました。
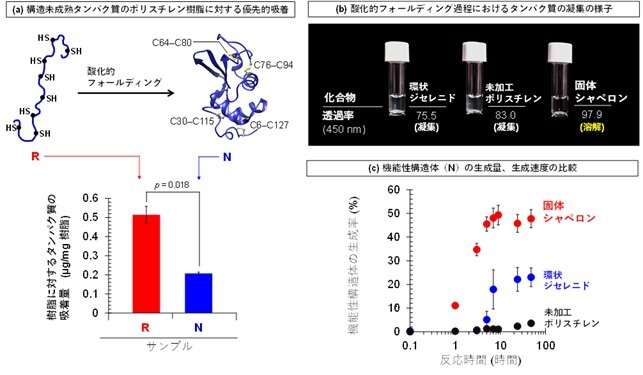
図3: 高濃度基質タンパク質条件下における、凝集と競合する酸化的フォールディングの促進。(a) 還元変性タンパク質(R)から天然構造タンパク質(N)への酸化的フォールディングの模式図。固体シャペロンは、フォールディング途中の未成熟タンパク質を一時的に捕捉し、凝集を抑制しながら正しい立体構造形成を促進する。(b)各条件における反応後試料溶液の外観写真および 450 nm における透過率。環状ジセレニド単体および未加工ポリスチレンでは懸濁が観測されるのに対し、固体シャペロンを用いた場合には高い透明性が維持された。(c)モデルタンパク質の酸化的フォールディング反応における生成物解析結果。固体シャペロン存在下では、天然構造体(N)の生成が顕著に促進されている。
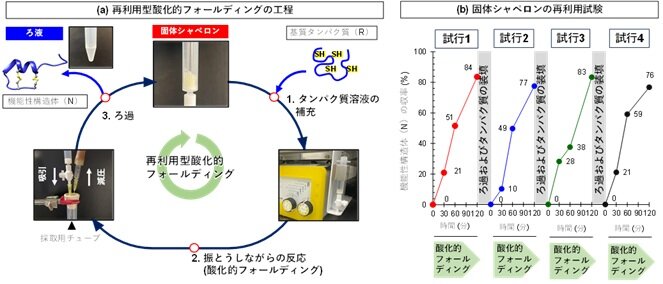
図4: 固体シャペロンを用いた再利用可能な酸化的フォールディング工程。(a) 固体シャペロンを用いた再利用可能な酸化的フォールディングのワークフローを示す。還元変性タンパク質溶液を固体シャペロンと接触させ、振とう下でインキュベーションすることで酸化的フォールディングを進行させた後、ろ過操作により生成物溶液を回収する。回収後の固体シャペロンは洗浄を経て再び反応に供することができ、繰り返し使用が可能である。(b) 固体シャペロンの再利用試験における酸化的フォールディング挙動の比較。固体シャペロンを回収・再使用した各試行においても、安定して酸化的フォールディングが進行することが示された。
■まとめと今後の展開
本研究では、環状ジセレニド分子をポリスチレン樹脂に固定化した「固体シャペロン」を開発し、酵素を用いずにタンパク質の酸化的フォールディングを効率よく促進できることを明らかにしました。この固体シャペロンは、フォールディング途中のタンパク質の凝集を抑制しながら正しい立体構造形成を導き、高収率で天然構造タンパク質を得られるとともに、反応後に回収・再利用が可能であるという特長を有しています。
これにより、従来必要とされてきたHPLC精製を行わない簡便なタンパク質製造プロセスの実現可能性が示されました。本研究は、生体内でPDIが担うフォールディング補助機能を固体材料上で再構築するという新しい概念を提示するものであり、今後は適用可能なタンパク質の拡張やプロセス条件の最適化を進めることで、バイオ医薬品タンパク質の効率的かつ持続可能な生産技術への応用が期待されます。
【掲載論文】
|
タイトル |
: |
Beyond Folding Enzymes: A Redox-Active "Solid Chaperone" Unlocks Recyclable, HPLC-Free Oxidative Protein Folding |
|
著者 |
: |
岩本駿平1、西沢優也1、横瀬颯人2、蟹江治3、岡村陽介4、村岡貴博5、荒井堅太6 |
|
所属情報 |
: |
1. 東海大学大学院理学研究科化学専攻 2. 東海大学大学院総合理工学研究科総合理工学専攻 3. 東海大学工学部生物工学科 4. 東海大学マイクロ・ナノ研究開発センター 5. 東京農工大学大学院工学研究院応用化学部門 6. 東海大学先進生命科学研究所 |
|
DOI |
: |
10.1021/jacsau.5c01572 |
|
URL |
: |
用語解説
ジスルフィド結合*1
タンパク質中の2つのシステイン残基の硫黄原子同士が結合して形成される化学結合。タンパク質の立体構造を安定化する重要な要素の一つ。
酸化的フォールディング*2
ジスルフィド結合を持たない還元変性タンパク質が、ジスルフィド結合の形成(酸化反応)を伴いながら正しい機能性構造体へと折りたたまれるプロセス。
小胞体*3
真核細胞内に存在する膜構造体で、分泌タンパク質や膜タンパク質の合成・フォールディング・品質管理を担う重要な細胞内小器官。
プロテインジスルフィドイソメラーゼ(PDI)*4
小胞体内に存在する酵素で、ジスルフィド結合の形成や組み換えを促進し、タンパク質の正しい酸化的フォールディングを助ける。
分子シャペロン*5
タンパク質が正しい立体構造を形成する過程で、一時的に結合して凝集を防ぎ、適切なフォールディングを補助するタンパク質群の総称。
凝集*6
フォールディング途中の未成熟なタンパク質同士が不適切に結合し、溶解性を失って塊状になる現象。機能不全や製造効率低下の原因となる。
高速液体クロマトグラフィー(HPLC)*7
液体を移動相として用い、化合物やタンパク質を分離・精製・分析する手法。高い分離能を有するが、工程やコストがかかる。
環状ジセレニド分子*8
2つのセレン原子が結合したジセレニド結合を含む環状化合物。可逆的な酸化還元反応が可能で、酸化的フォールディングの促進に利用される。
<研究に関するお問い合わせ>
東海大学 先進生命科学研究所 荒井堅太
TEL.0463-58-1211(直通)
東京農工大学 大学院工学研究院応用化学部門 村岡貴博
TEL.042-388-7052(直通)
<広報に関するお問い合わせ>
東京農工大学 総務課広報室
TEL.042-367-5930(直通) E-mail:muraoka@go.tuat.ac.jp
東海大学 学長室広報担当:喜友名(きゆな)、林
TEL.0463-63-4670(直通) E-mail:upr@tokai.ac.jp

