ここから本文です
左右の腎臓が互いに機能のバランスを調節するメカニズムを解明
2025年06月23日
左右の腎臓のうち片側だけに障害を誘導することのできる独自のマウスモデルを開発しました。これを用いて「左右の腎臓が機能的・構造的なバランスを保とうとする現象(腎カウンターバランス)」の分子メカニズムを初めて明らかにしました。
腎臓は左右一対の臓器であり、一方の腎機能が低下すると、他方が代償的に働きを高めることが知られており、このような左右間の動的なバランス調節は、「腎カウンターバランス」と呼ばれています。しかしながら、そのメカニズムは長年不明でした。
本研究では、マウスの糸球体足細胞(腎臓の糸球体表面の上皮細胞)に選択的な障害を与え、片側の腎臓のみに足細胞障害を誘導する 2K1N モデルを開発しました。このモデルでは、障害腎への血流が時間の経過とともに著しく低下し、障害腎由来の蛋白尿は消失しました。そして、健常側の腎臓が代償的に機能を担い、全身の水バランスや血圧が維持されていました。一方、両側の腎臓に同等の障害を負わせた 2K2N モデルでは、血流の不均衡が認められず、全身性の浮腫や蛋白尿が悪化しました。
この 2K1N モデルを用いて、腎臓内の遺伝子発現と分子レベルの変化を詳しく調べた結果、障害を受けた腎臓と健常な腎臓とで血圧を上昇させるホルモンである Ang II の産生量が顕著に異なり、この局所的な Ang II の不均衡が、障害腎の血流低下と糸球体虚脱を引き起こすことが明らかになりました。
これらの結果から、左右の腎臓が互いに影響を及ぼし合いながらバランスを取ろうとする中で、そのバランスが崩れることが、腎疾患の進行に深く関与していることが示唆されました。
研究代表者
筑波大学医学医療系
坂本 和雄 人間総合科学研究科生命システム医学専攻 (研究当時、現:神戸大学医学部附属病院 腎・血液浄化センター 特定助教)
川西 邦夫 助教(研究当時、現:昭和医科大学医学部解剖学講座顕微解剖学部門 教授)
筑波大学生存ダイナミクス研究センター
金 俊達 助教(研究当時、現:富山大学 和漢医薬学総合研究所 研究開発部門 複雑系解析分野 准教授)
東海大学 医学部 医学科生体機能学
松阪 泰二 教授
研究の背景
慢性腎臓病は、加齢、高血圧、糖尿病、糸球体腎炎など多様な要因によって発症し、進行すると腎機能が不可逆的に低下し、透析や腎移植といった腎代替療法が必要となります。世界的に重大な健康問題となっており、日本国内でも末期腎不全の患者数は年々増加しています。近年では、急性腎障害から慢性腎臓病への進展メカニズムの研究が進み、早期診断と介入の重要性が認識されつつあります。
腎臓疾患の研究では、従来、一側性(片側にのみ生じる)の尿管閉塞(逆流性腎障害)注 1)や一側性虚血再灌流障害注 2)といった、主に尿細管間質に障害を与える動物モデルが用いられてきました。これらのモデルは技術的に安定しており、慢性障害の再現性にも優れていますが、尿細管障害を中心とした病態を反映しているため、糸球体(血液をろ過する組織)に起因する病態や、左右の腎臓が互いに影響し合う「システム」としての腎疾患メカニズムを明らかにするには限界があるとされてきました。
本研究では、新たなマウスモデルを開発し、左右のうち一方の腎臓が障害を受けた際に、障害を受けた腎臓では血流の低下と構造的な萎縮が進行し、反対側の腎臓が代償的に機能亢進・肥大を示す、といった左右の腎臓間での非対称的な適応現象(腎カウンターバランス)注 3)のメカニズム解明に取り組みました。この現象は、単なる「片腎の肥大」ではなく、二つの腎臓が互いに「競合」しながら全体の腎機能の均衡を保とうとする精緻な生理的ネットワークとして理解されています。
研究内容と成果
本研究では、糸球体の足細胞注 4)特異的にヒト CD25 を発現する NEP25 マウス(ネフローゼ症候群モデル)注 5)を用い、CD25 に対する免疫トキシン LMB2 を投与することで、足細胞障害(グロメルロパチー)を片側の腎臓にのみ生じさせることのできる 2K1N(two-kidney, one-nephropathy)マウスモデルを作製しました。この 2K1N モデルでは、障害腎における腎血流が時間依存的に低下し、健常腎では代償性の安定化がみられました。一方、両側に同等の障害を負わせた 2K2N モデルでは血流の不均衡が認められず、全身性の浮腫や蛋白尿が増悪しました。これにより、左右の腎臓間での機能的競合とその不均衡が、腎疾患の進展に大きく関与することが示されました。また、2K1N および 2K2N モデルについて、トランスクリプトーム(RNA-seq)解析注 6)および分子生物学的手法で詳しく調べたところ、血圧を上昇させるホルモンである Ang II(アンジオテンシン II)注 7)の生成に関わるタンパク質分解酵素 Ren1(レニン)注 8)発現の左右差が明らかとなり、腎 Ang II の発現量も障害腎側で顕著に増加していました。これに対し、アンジオテンシン変換酵素阻害薬を投与すると、血流低下と糸球体病変が改善され、局所的なAng II の調節が腎カウンターバランスの正常化に寄与することが示唆されました(参考図)。
今後の展開
本研究は、これまで尿細管間質障害モデルが使われてきた慢性腎疾患研究に対して、糸球体の病変に着目した新たな実験モデルを提供するものです。今回構築した 2K1N モデルは、2 つある腎臓のうち一方だけに糸球体障害を選択的に誘導することが可能で、もう一方の健常腎との比較によって、腎臓同士がどのように影響を与え合っているか、すなわち腎カウンターバランスの動態を詳細に解析できる点が大きな特徴です。このモデルにより、腎動脈狭窄や片腎摘出後の代償反応など、一側性腎疾患に特有の病態進展の仕組みの解明や、腎移植患者において、もともとの病気の腎臓と新たに移植された健康な腎臓との間に生じるカウンターバランス関係を分子レベルで明らかにすることが可能となります。今後さらに、局所的な Ang II の調節機構の解明やその治療的制御を含む、臨床応用への橋渡し研究を進める予定です。
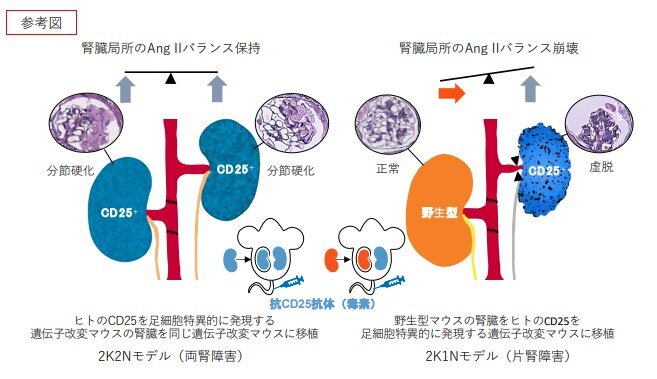
図 2 K1N および 2K2N モデルにおいて、ヒト CD25 を足細胞に発現する遺伝子改変マウスに抗ヒトCD25 免疫トキシンを投与することで、選択的に糸球体障害を誘導可能なネフローゼモデルを作製した。2K2N モデル(両腎障害、左図)では尿蛋白の増加と糸球体硬化が顕著であり、腎臓局所でのAng II 産生の亢進と一致した。一方、2K1N モデル(片腎障害、右図)では Ang II の産生に左右差が生じ、障害腎側での過剰な Ang II 上昇が腎血流の低下および糸球体虚脱の進行と関連した。これにより、Ang II の非対称な局所活性化が腎カウンターバランスの一因となる可能性が示唆された。
用語解説
注 1)一側性の尿管閉塞(逆流性腎障害)
片側の尿管を閉塞することにより、片側の腎臓に慢性的な尿路うっ滞を生じさせる実験モデル。主に尿細管間質障害を再現するために広く用いられる。繊維化や炎症反応、酸化ストレスなど、慢性腎疾患の進展に関与する経路の解析に適している。
注 2)一側性虚血再灌流障害
腎臓の血流を一時的に遮断した後に再灌流させることで酸化ストレスや炎症を誘導するモデル。主に急性腎障害から慢性腎疾患への移行過程のメカニズム解析に用いられる。障害の主体は尿細管である。
注 3)腎カウンターバランス
左右の腎臓間における非対称な適応応答。片側の腎臓に障害が生じると、健常側が代償的に機能亢進や肥大を示す一方、障害側では血流低下や萎縮が進行する。1923 年に Frank Hinman により提唱された概念で、両腎が競合的に腎機能の均衡を保とうとする生理的機構とされる。
注 4)足細胞
腎臓内の糸球体(血液ろ過バリア)の最外層に位置する特殊な上皮細胞。細長い突起(足突起)が糸球体基底膜に沿って配置されている。障害されると糸球体ろ過構造が破綻し、蛋白尿などネフローゼ症候群の原因となる。
注 5)ヒト CD25 を発現する NEP25 マウス(ネフローゼ症候群モデル)
糸球体の足細胞にヒト CD25(インターロイキン-2 受容体 α 鎖)を特異的に発現する遺伝子改変マウス。このマウスに対して、ヒト CD25 に特異的な免疫トキシンを投与することで、足細胞が選択的に障害され、短期間でネフローゼ症候群様の病態(高度蛋白尿、浮腫、糸球体障害など)が誘導される。糸球体疾患、特に足細胞障害に起因する腎疾患の発症機構や治療介入の評価において広く用いられる。
注 6)トランスクリプトーム(RNA-seq)解析
細胞や組織における全転写産物(RNA)の発現量を網羅的に解析する手法。発現変動遺伝子の同定やパスウェイ(遺伝子の相互作用)解析を通じて、病態に関わる分子機構の解明が可能となる。
注7)Ang II(アンジオテンシン II)
血管収縮作用、ナトリウム再吸収促進、炎症や線維化の誘導など、腎機能制御と病態形成の両面に関与するタンパク質。特に腎臓局所での Ang II の過剰は、糸球体病変の進行要因となる。
注8)Ren1(レニン)
腎臓の顆粒細胞で分泌され、アンジオテンシノーゲンから Ang I を生成する酵素。Ren1 はマウスのレニン遺伝子であり、局所レニン-アンジオテンシン系活性の指標として用いられる。
研究資金
本研究は、日本学術振興会 科学研究費補助金(JP25K19492・JP17K09685)、科学技術振興機構(JST)START大学発新産業創出タイプ(JPMJST2052)、日本医療研究開発機構(AMED-CREST)(JP21gm1410010)の支援を受けて行われました。
掲載論文
| 【題 名】 | A Novel Glomerulopathy Model Demonstrates Renal Counterbalance via Local Angiotensin II Regulation (新規糸球体腎症モデルを用いた腎局所アンジオテンシン II による腎カウンターバランス制御機構の解明) |
| 【著者名】 | Kazuo Sakamoto1,8, Kunio Kawanishi1,2,3, Jun-Dal KIM4,5,6, Masahiro Koizumi7, Shin-ichi Muroi4,6, Saori Tabara5, Akiyoshi Fukamizu5,6, Taiji Matsusaka7, and Michio Nagata1 |
| 1筑波大学 医学医療系 腎・血管病理学 2筑波大学 医学医療系 実験病理学 3昭和医科大学 医学部 解剖学講座 顕微解剖学部門 4富山大学 和漢医薬学総合研究所 研究開発部門 複雑系解析分野 5筑波大学 生存ダイナミクス研究センター(Tsukuba Advanced Research Alliance:TARA) 6国立研究開発法人 日本医療研究開発機構(AMED)CREST プログラム 7東海大学 医学部 基礎医学系 生体機能学領域 8神戸大学医学部附属病院 腎・血液浄化センター |
|
| 【掲載誌】 | Proceedings of the Japan Academy, Series B(日本学士院紀要 B) |
| 【掲載日】 | 2025 年 6 月 20 日(オンライン先行公開) |
| 【DOI】 | 10.2183/pjab.101.025 |
問合わせ先
【研究に関すること】
川西 邦夫(かわにし くにお)
昭和医科大学 医学部 解剖学講座 顕微解剖学部門 教授 (兼 筑波大学 医学医療系 非常勤研究員)
TEL: 029-853-3944
URL: https://www.md.tsukuba.ac.jp/epatho/index.html
【取材・報道に関すること】
筑波大学広報局
TEL: 029-853-2040
E-mail: kohositu@un.tsukuba.ac.jp
神戸大学総務部広報課
TEL: 078-803-5106
E-mail: ppr-kouhoushitsu@office.kobe-u.ac.jp
昭和医科大学 総務部総務課 大学広報係
TEL: 03-3784-8059
E-mail: press@ofc.showa-u.ac.jp
富山大学総務部総務課広報・基金室
電話:076-445-6028
E-mail:kouhou@u-toyama.ac.jp
東海大学医学部付属病院 事務部事務課(広報)
TEL: 0463-90-2001
E-mail:prtokai@tokai.ac.jp

