ここから本文です
カルシウムイオン濃度変化に合わせて活性を変調させる 生体適合型の酸化還元触媒開発に成功 ~筋ジストロフィーなどの治療見据え、新たなプロドラックデザインの基盤を構築~
2025年03月11日
東海大学[湘南キャンパス]理学部化学科准教授の荒井堅太(先進生命科学研究所兼務)および総合理工学研究科総合理工学専攻材料・化学コース2年次生の三神瑠美らで構成する研究グループは、細胞内のカルシウムイオン濃度に応答して、酸化還元活性強度を変調させる生体適合型触媒の開発に成功しました。なお、本研究成果は3月11日(火)付で英国の国際化学誌「Communications Chemistry」電子版に掲載されました。
|
<本研究成果のポイント> ◇ カルシウムイオン濃度依存的に活性を変調させる「アロステリック触媒」の化学合成に成功 ◇ アロステリック触媒による生体関連酸化還元反応の速度制御に成功 ◇ 細胞内カルシウムイオン濃度の上昇に伴って、アロステリック触媒が活性化され、細胞内の酸化還元バランスを調節することを解明 |
■成果の概要
人工的に作られる化学触媒は、細胞内代謝を制御する薬剤として高い可能性を有しています。しかし、従来の触媒化学では、触媒活性と細胞毒性が二律背反の関係にあり、細胞内で適切に触媒活性を発揮させることは困難でした。触媒化学と生物学の接点におけるこの重大な問題を克服するため、本研究グループは、特定のタイミングで触媒活性を発揮することができる新たな生体適合型の酸化還元触媒「アロステリック触媒」を開発しました。同触媒は、細胞内の酸化還元状態を制御している重要因子のカルシウムイオン濃度の変化に応答し、タンパク質の構造化(酸化)や活性酸素種除去(還元)を促進する能力を可逆的に亢進・低下させることができます。低カルシウムイオン濃度では、同触媒はほぼ不活性であり、細胞毒性を示しません。一方で、カルシウムイオン濃度が上昇した特定の条件下では、同触媒が活性化され、細胞内の酸化還元恒常性を保つ機能を適切に発揮します。
本研究で開発したこのスマート触媒は、細胞内の酸化還元バランスの不均衡によって引き起こされる神経変性疾患、筋ジストロフィー、糖尿病などのさまざまな疾患に対する薬剤の分子設計に新たな一手を提案するものです。
本研究成果が掲載された「Communications Chemistry」は、オープンアクセスであることから、どなたでも閲覧が可能です。また、研究の実施にあたり、文部科学省科学研究費助成事業および日本私立学校振興・共済事業団による助成を受けました。
■研究の背景
細胞の代謝異常は、酸化ストレス、タンパク質の構造不全、糖化ストレス、核酸修飾などの望ましくない化学的事象を誘発し、最終的には不可逆的な細胞の病理的変性を引き起こします。人工触媒*1は、細胞内の化学反応を制御する酵素の機能を補助・増強することで、細胞の恒常性*2を調節することが可能です。また、さまざまな疾患に対する治療戦略の幅を広げる可能性も有しています。しかしながら、高い触媒能力を持つ化合物は一般的に高い細胞毒性を示すことから、利用は困難とされてきました。この二律背反の関係を解消するため、本研究グループは特定のタイミングで適切に触媒能力を発揮する触媒の開発を試みました。
生体内の一部の酵素は、金属イオン(Mn+)を自身に取り込むことで構造を変え、状況に応じた最適な活性強度を発現します(図1a)。本研究では、アロステリック酵素と呼ばれるこのような生体分子の仕組み(アロステリック効果)を模倣し、細胞内で流動的かつ可逆的に濃度を変化させるカルシウムイオン(Ca2+)に着目。Ca2+を取り込むことで活性を亢進させる人工アロステリック触媒の開発に成功しました(図1b)。
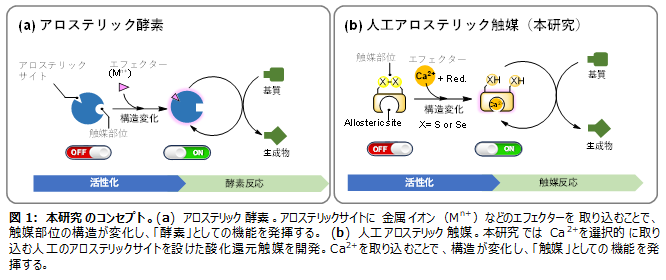
■研究の主要成果
成果1:Ca2+に応答するアロステリック触媒の合成に成功
分子内にジスルフィド*3およびジセレニド*4結合を有する化合物は、これらの結合が切れることで、チオールおよびセレノールと呼ばれる活性種へと変換されます。チオールやセレノールは高い反応性を有し、タンパク質の構造化(酸化)や活性酸素種の無毒化(還元)を促進します。一方で、これらの活性種は強い毒性を示すことも知られており、細胞内での不適切なジスルフィドとジセレニドの結合の切断は、細胞死を引き起こす要因ともなります。本研究では、細胞内のCa2+濃度が上昇したときのみ、活性化されたチオールおよびセレノールに変換される仕組みを付与するため、Ca2+のセンサーとして配位子*5を接合した環状ジスルフィド化合物(BAPDiT)およびジセレニド化合物(BAPDiS)を合成しました(図2a)。これらの化合物は、配位子部分にCa2+を取り込むことで、環状骨格部分にゆがみが生じ、還元剤の存在下で容易にチオールおよびセレノール体へと活性化されます。実際にCa2+の存在下では酸化還元電位*6が大幅に上昇し、ジスルフィドおよびジセレニド結合の安定性が著しく低下することが明らかになりました(図2b)。この結果は、Ca2+の存在下でのみ、生体関連の酸化還元反応を促進する可能性を示唆しています。
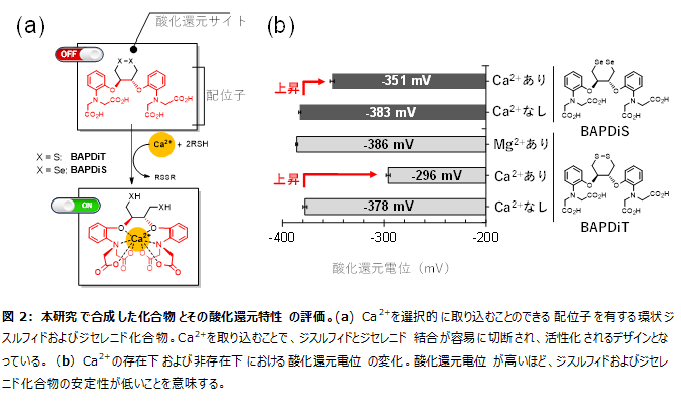
成果2:アロステリック触媒による生体関連酸化還元反応の速度制御
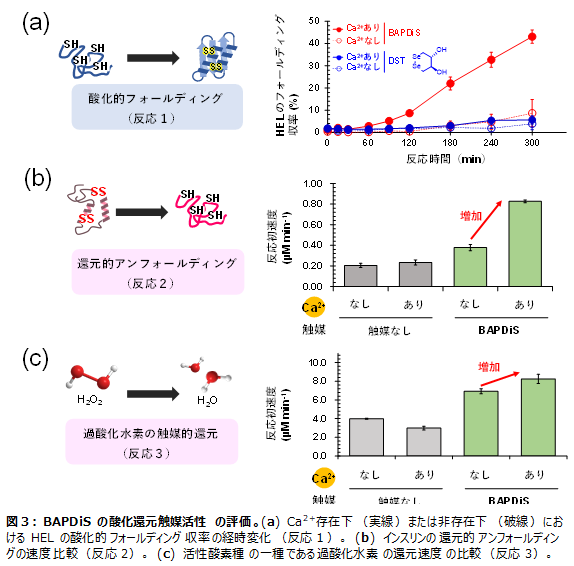
次に、生体内の酸化還元恒常性維持に重要な以下3種の反応に対して、どの程度BAPDiTおよびBAPDiSが反応を促進する能力を有しているか調査しました。実験はCa2+の存在下・非存在下で実施し、Ca2+の濃度変化による各反応の速度制御の可否について評価しました。
<反応1> タンパク質の酸化的フォールディング(タンパク質の構造化 [酸化]:図3a)
<反応2> タンパク質の還元的アンフォールディング(タンパク質の構造変性 [還元] :図3b)
<反応3> 過酸化水素の触媒的還元(活性酸素種の無毒化 [還元]:図3c)
※ここではBAPDiSにフォーカスを当て、成果を概説
<反応1>
タンパク質の酸化的フォールディングは、生体内で合成されたポリペプチド鎖が生理活性のあるタンパク質として機能するための重要な構造化プロセスです。多くのタンパク質は分子内のジスルフィド架橋によって構造が安定化されているため、フォールディングには酸化的な環境でのジスルフィド形成が連動する必要があります。4つのジスルフィド結合をすべて切断したニワトリ卵白リゾチーム(HEL)の酸化的フォールディングに各化合物を酸化触媒として添加し、一定時間後のHELのフォールディング収率を見積もりました(図3a)。Ca2+の非存在下では、リゾチームのフォールディングはほとんど進行しませんでしたが、Ca2+を添加すると5時間後にフォールディング収率が45%に達しました。一方、配位子部位を持たない化合物(DST)はCa2+の存在下、非存在下いずれにおいてもリゾチームのフォールディングを促進しませんでした。
<反応2>
タンパク質の還元的アンフォールディングは、酸化的フォールディングの逆反応であり、タンパク質の分解や品質管理に重要な反応です。本研究では、還元触媒としてBPADiSを用い、ジスルフィド結合を3つ有するインスリンの還元的アンフォールディングを行ったところ、Ca2+の非存在下では触媒を加えていないコントロールと比較して反応初速度の増加は1.5倍程度なのに対し、Ca2+の共存環境下では、速度を4倍加速させました(図3b)。
<反応3>
同様の傾向は、活性酸素種である過酸化水素(H2O2)の触媒的還元実験でも観測されました。Ca2+は、BAPDiSoxの触媒活性を上方制御し、Ca2+存在下のH2O2の還元速度はCa2+非存在下と比較しても、さらに1.1倍加速しました(図3c)。
これらの結果は、Ca2+がBAPDiSoxを高活性セレノール種へと変換する開環反応を補助し、生体関連酸化還元に対する触媒機能を強化したことを示唆しています。つまり、Ca2+濃度の増減が反応各種のアクセルおよびブレーキとして機能し、反応速度を自在に制御できることを意味しています。BAPDiSおよびBAPDiTのCa2+による触媒活性制御機構を活用することで、細胞内における特定の病理的状況においてのみ適切な酸化還元触媒活性を発揮する生体適合型触媒として応用できる可能性があります。
成果3:アロステリック触媒による細胞内の酸化還元恒常性制御
小胞体は、高濃度(~1mM)のCa2+を貯蔵し、細胞のCa2+濃度を制御しています。sarco/endoplasmic reticulum Ca2+-ATPase (SERCA)は、筋小胞体膜に存在するタンパク質で、Ca2+の濃度ギャップに逆らって細胞質からCa2+を小胞体内へ取り込むポンプの役割を担っています(図4a)。SERCAの機能不全は、細胞質のCa2+濃度上昇とそれに伴うミトコンドリアの機能障害ならびに細胞質の活性酸素種の増加を介して、癌化、脱神経、筋ジストロフィーなど、多くの慢性病態と関連していることが報告されています。Ca2+をトリガースイッチとして酸化還元触媒活性を発現する本化合物は、SERCA関連疾患に抵抗するための理想的な化学的特性を有します。
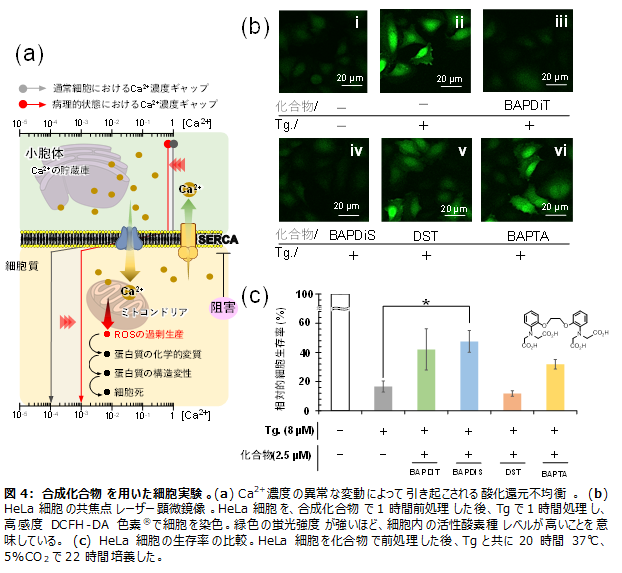
HeLa細胞をSERCAの強力な阻害剤であるタプシガルギン(Tg)で処理し、細胞内の活性酸素レベルをDCFH-DA色素®を用いて測定しました。緑色の蛍光強度の増加から明らかなように、活性酸素レベルが大幅に増加しました(図4b-ii)。対照的に、BAPDiTおよびBAPDiSをあらかじめ細胞内に取り込ませると、蛍光強度は著しく減少し、活性酸素種の増加が抑えられたことが明らかとなりました(図4b-iiiおよび4b-iv)。一方、Ca2+に対するリガンドおよび酸化還元活性部位を欠くDSTおよびBAPTAは、BAPDiTまたはBAPDiSよりも活性酸素レベルを減少させる能力が著しく低いことも判明しました(図4b-vおよび4b-vi)。これらの観察結果は、細胞質で増加したCa2+が化合物の配位子に結合することで、アロステリック効果により化合物が活性化され、還元触媒として機能し、細胞質酸化還元バランスを調節していることを示す状況証拠となります。今回、BAPDiSをあらかじめHeLa細胞に取り込ませることで、Tgで22時間処理した後の細胞生存率が対照群と比較して有意に改善されることも明らかとなりました(図4c)。
■まとめと今後の展開
従来の触媒化学では、触媒の反応性と細胞毒性は二律背反の関係にあり、生物学的利用は極めて困難でした。今回、細胞環境に応じて生物活性をアップレギュレーションまたはダウンレギュレーションできる細胞駆動型触媒を開発したことで、必要な時・場所で特定の反応を促進できる低分子機械の開発基盤を構築できたことになります。これにより、金属イオンのリガンドの構造を改変することで、アロステリックエフェクターの種類や選択性を変えることも可能になると期待されます。さらに、アロステリック触媒にドラッグデリバリーシステムの概念を取り入れることで、特定の組織や器官を標的としたプロドラッグ*7として利用できる可能性も広がります。また、SERCA 機能不全による小胞体内のCa2+枯渇は、小胞体ストレス*8を誘導し、糖尿病や各種神経変性疾患の発症にも深く関わっていることが指摘されています。本研究グループでは現在、筋ジストロフィー、神経変性疾患、糖尿病などの酸化還元関連疾患の治療にプロドラッグとして実用化できる新しいタイプのアロステリック触媒の開発を目指して研究を進めています。
【掲載論文】
|
タイトル |
: |
Ca2+-triggered allosteric catalysts crosstalk with cellular redox systems through their foldase- and reductase-like activities |
|
著者 |
: |
三神瑠美1、佐藤悠平1、金村進吾2、村岡貴博3,4、奥村正樹2,5、荒井堅太1,6 |
|
所属情報 |
: |
1. 東海大学理学部化学科 2. 東北大学学際科学フロンティア研究所 3. 東京農工大学大学院工学研究院 4. 神奈川県立産業技術総合研究所 5. 東北大学大学院生命科学研究科 6. 東海大学先進生命科学研究所 |
|
DOI |
: |
10.1038/s42004-025-01466-6 |
|
URL |
: |
用語解説
人工触媒*1
生体内に存在する生体触媒(酵素)とは異なり、人為的に設計・合成された触媒のこと。ごく少量で特定の化学反応を効果的に促進する(反応を早める)試薬のこと。
恒常性*2
外界の環境や、内部の変化に対して常に生命維持に必要な生理的な機能を正常に保とうとする仕組み。
ジスルフィド*3
チオール(SH)基とよばれる硫黄原子(S)を含む部位が接近し、酸化されることで形成される結合のこと。ジスルフィドはタンパク質の構造安定化因子の一つでもある。
ジセレニド*4
ジスルフィド結合のSがセレン原子(Se)に置き換わった結合のこと。セレノール(SeH)基と呼ばれるSeを含む部位が接近し、酸化されることで形成される。
配位子*5
金属イオンを結合することのできる特定の部分あるいは分子の総称であり、リガンドともいう。
酸化還元電位*6
ある酸化還元反応における物質の電子の放出のしやすさ、あるいは受け取りやすさを表す指標のこと。ジスルフィドおよびジセレニド化合物の場合、酸化還元電位の上昇は、その結合が切れやすくなった(電子を受け取りやすくなった)ことを意味する。
プロドラッグ*7
そのままでは効果を発揮しないが、体内の標的部位に到達し、代謝されることで効果を発揮するタイプの薬のこと。投与前はほとんど活性化されていない、もしくは不活性の状態であるが、投与後に体内で起こる代謝によって本来の薬効を示す。
小胞体ストレス*8
小胞体内でタンパク質が正常に折りたたまれず、構造不全タンパク質が蓄積する状態のこと。小胞体内におけるCa2+の濃度減少は小胞体ストレスを誘発する一因として考えられており、神経変性疾患や糖尿病などの発症を助長するという報告がなされている。
|
<研究に関するお問い合わせ> 東海大学 理学部化学科 荒井堅太 TEL.0463-58-1211(直通) <広報に関するお問い合わせ> 東海大学 学長室広報担当:喜友名(きゆな)、林 TEL.0463-63-4670(直通) E-mail:upr@tokai.ac.jp |

