ここから本文です
東海大学、山梨大学の共同研究グループ 妊娠ホルモン「リラキシン」の高効率合成に成功 ~人工リラキシンが子宮内膜症創薬戦略の新たな一手に~
2024年06月20日
東海大学理学部化学科准教授の荒井堅太(同大学先進生命科学研究所兼務)および同学科教授の岩岡道夫(同大学先進生命科学研究所長兼務)、山梨大学医学部産婦人科学講座教授の吉野修および同講座臨床助教の小野洋輔らで構成する共同研究グループは、妊娠ペプチドホルモンとして知られる「ヒトリラキシン-2(以下、リラキシン)」が持つ3対のジスルフィド結合*1のうち1対を類縁のジセレニド結合*2に置き換えた2種類の人工リラキシン(以下、セレノリラキシン)の化学合成に初めて成功しました。
同研究グループは、セレノリラキシン各種が子宮内膜症*3患者由来の子宮内膜間質細胞において、子宮内膜症の発症に関与するとされる組織繊維化因子の一つであるPAI-1のメッセンジャーRNA(mRNA)*4の発現量を最大40%まで減少させることを明らかにしました。本研究成果は、ジスルフィド結合をジセレニド結合に置換する分子設計戦略がリラキシンの合成を効率化する化学技術戦略としてだけでなく、子宮内膜症に対する創薬戦略として新たな一手を提案するものです。
本研究成果は、6月14日(金)付でイギリスの王立化学会が発行する『RSC Chemical Biology』電子版に掲載されました。当該記事はオープンアクセスで、どなたでも閲覧が可能です。また、研究を実施するにあたり、文部科学省科学研究費助成事業(東海大学)、日本私立学校振興・共済事業団(東海大学)による援助を受けました。
|
■本研究成果のポイント ◇ セレン原子の高い反応性を利用することで、効率的な人工リラキシン「セレノリラキシン」の化学合成法を確立した。 ◇ 「セレノリラキシン」は野生型のリラキシンと同等の立体構造を持つ。 ◇ セレノリラキシン各種は、子宮内膜症関連因子の発現を野生型のリラキシンよりも効果的に抑制する。 |
|
タイトル |
: |
Seleno-relaxin analogues: Effect of internal and external diselenide bonds on the foldability and a fibrosis-related factor of endometriotic stromal cells |
|
著者 |
: |
荒井堅太1、岩岡道夫1、片山秀和2、吉野修3、小野洋輔3 |
|
所属情報 |
: |
1.東海大学理学部化学科、東海大学先進生命科学研究所 2.帝京大学リベラルアーツセンター 3.山梨大学医学部産婦人科学講座 |
|
DOI |
: |
doi.org/10.1039/D4CB00095A |
|
URL |
: |
https://pubs.rsc.org/en/content/articlelanding/2024/cb/d4cb00095a |
【研究の背景】
妊娠可能年齢の約10%の女性が罹患しているとされる子宮内膜症は、月経困難症、性交疼痛症、排便障害などを誘発し、女性のクオリティ・オブ・ライフ(QOL)を著しく低下させます。吉野を筆頭とする本共同研究グループは、2020年に妊娠ホルモンとして知られるヒトリラキシン-2(以下、リラキシン)が、子宮内膜症の緩和効果を持つ可能性を報告しており、リラキシンの薬剤応用への期待は急速に高まっています。
リラキシンは、A鎖(24アミノ酸残基)とB鎖(29アミノ酸残基)と呼ばれる二本のポリペプチド鎖*5から構成さる分子量約6000のタンパク質で、A鎖とB鎖間において2対、A鎖内において1対のジスルフィド(S-S)結合が形成されることで分子構造が安定化されます〔図1〕。化学反応の特性上、異なる二種類の物質間で選択的に結合をつくる(カップリングさせる)ことは技術的に困難であり、創薬分野において極めて重要なタンパク質であるにもかかわらず、その化学合成法は未だに確立されていません。
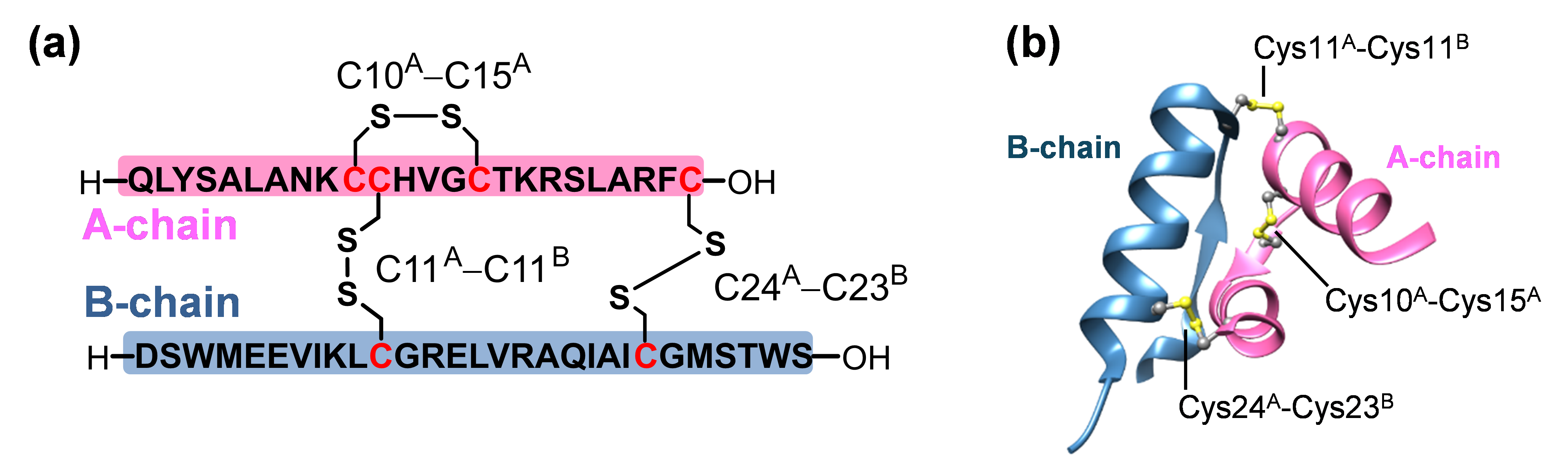
〔図1〕 リラキシンの構造(a)3対のジスルフィド結合でカップリングしたリラキシンのA鎖とB鎖のアミノ酸配列。大文字アルファベットはアミノ酸の種類を表す。(b)リラキシンの三次元立体構造(PDB code: 6rlx)
【研究の主要成果】
成果1:リラキシンの化学合成の高効率化を達成
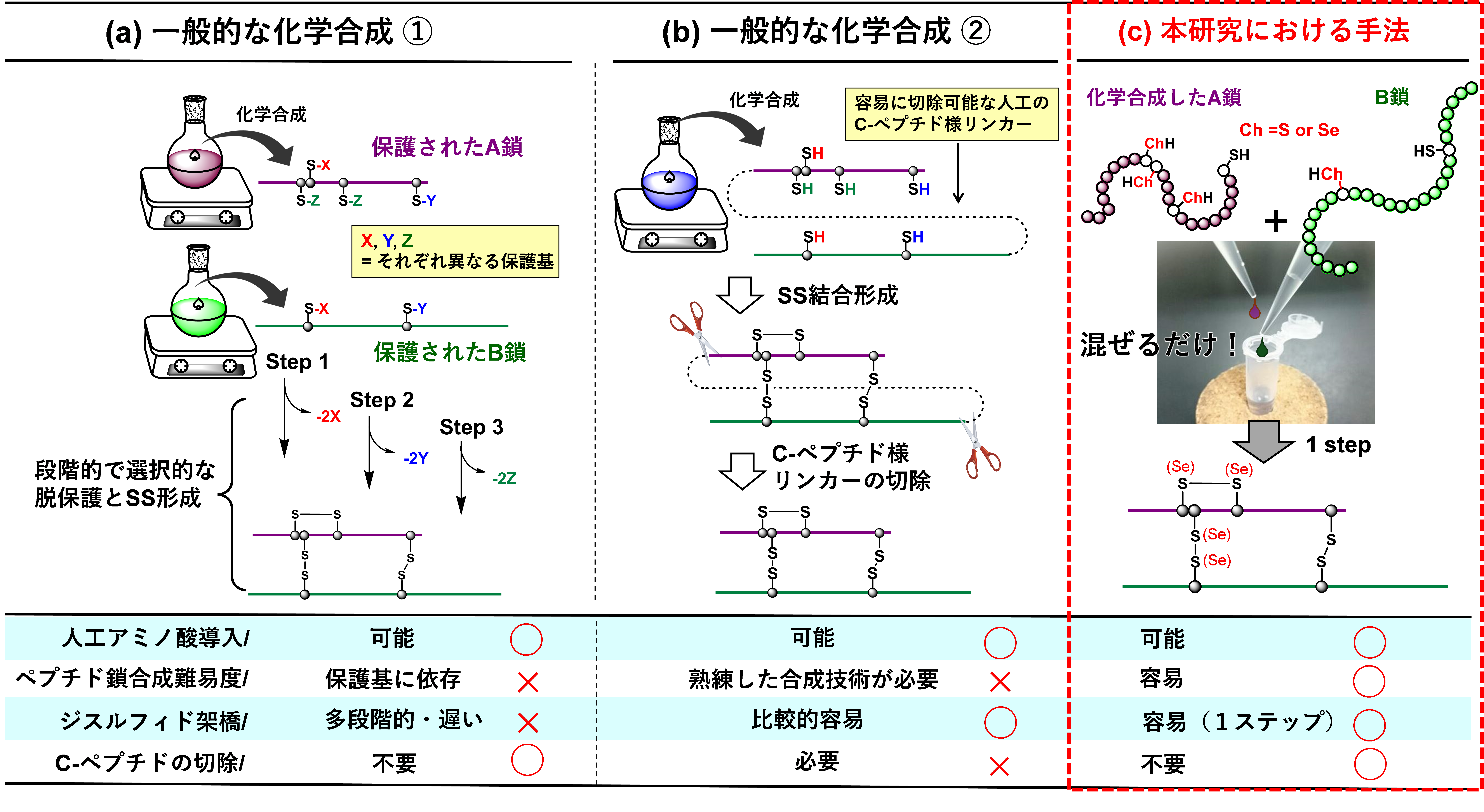
〔図2〕 リラキシン化学合成の例。(a)多種類の保護基の選択的な脱保護とジスルフィド結合架橋によるリラキシン合成。(b)生合成機構を模倣した一本鎖のリラキシン前駆体の合成とジスルフィド結合架橋を経由するリラキシン合成。(c)本研究で確立したセレン(Ch = Se)原子の高い反応性を利用することによる構成ペプチド鎖の直接的なカップリング。
遺伝子工学技術を利用し、大腸菌や酵母などの微生物にタンパク質を発現させる手法は、リラキシンの調製においても最も広く利用されます。しかし、非天然アミノ酸を導入したリラキシン製剤候補の探索には、対応する合成遺伝子の開発が必要であり、多種多様な製剤候補を迅速に生産する手法としては有用ではありません。これに対して、生物の力に頼らずに化学反応だけを用いてリラキシンを合成する技術の開発も進められており、非天然アミノ酸を含むリラキシン変異体の合成が容易となります〔図2〕。一方で、このような化学合成技法では、目的のリラキシンを得るまでに多段階的な工程を経由する必要があり、より簡便な合成技術の確立が課題となっています〔図2(a)および(b)〕。
本研究では、リラキシンが有するシステインを反応性の高いセレノシステインに置き換えることで、分子内の正しい位置にジスルフィド結合およびジセレニド結合の架橋を迅速かつ正確に促す合成戦略を採用し、これまでの化学合成技術が抱えていた問題を一挙に解決することに成功しました〔図2(c)〕。これは、以前に本研究の東海大学のグループが、リラキシンと類似の構造を有するインスリン*6の化学合成に利用した技術を応用したものです。
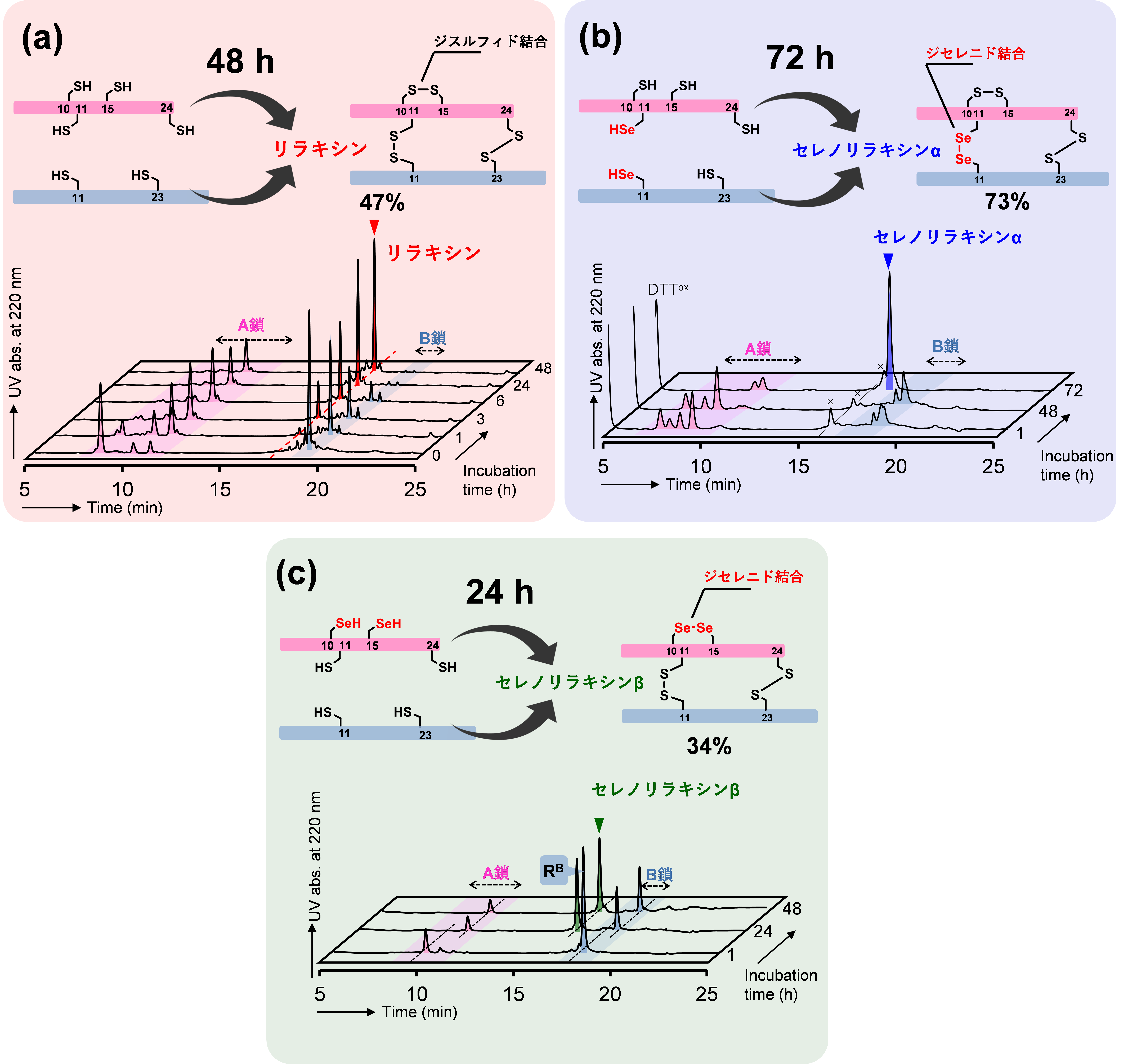
〔図3〕 Aおよび鎖B鎖の混合によるカップリング実験から得られたサンプルの高速液体クロマトグラフィー(HPLC)*7分析結果。 (a) 野生型リラキシンのA鎖およびB鎖のカップリング。48時間後に適切な場所にジスルフィド結合を形成したリラキシンが主生成物(赤色のピーク)として得られたことを表している。(b)セレノリラキシンαのA鎖およびB鎖のカップリング。72時間後に適切な場所にジスルフィド/ジセレニド結合を形成したセレノリラキシンαが主生成物(青色のピーク)として得られたことを表している。(c)セレノリラキシンβのA鎖およびB鎖のカップリング。24時間後に適切な場所にジスルフィド/ジセレニド結合を形成したセレノリラキシンαが主生成物(緑色のピーク)として得られたことを表している。
素材となるリラキシンA鎖およびB鎖を適当な添加剤の存在下、適切な組み合わせで混合することで、ワンステップで目的の各種リラキシン類縁体を得ることに成功しました〔図3〕。ジセレニド結合を持たない野生型のリラキシンは、48時間後に47%の収率で目的のリラキシンが得られたのに対して、リラキシンの分子表面に露出したジスルフィド結合をジセレニド結合に置き換えたセレノリラキシンαは、A鎖とB鎖のカップリングの収率を大幅に向上させ、72時間後に最大収率73%で得ることができました。一方で、リラキシンの分子内部に埋没したジスルフィド結合をジセレニド結合に置き換えたセレノリラキシンβの最大収率は34%と野生型よりもわずかに低かったものの、反応は24時間以内に完結しました。
すなわち、分子表面のジセレニド結合はカップリングの収率を、分子内部のジセレニド結合はカップリングの速度をそれぞれ制御することがわかりました。また、単離されたリラキシンおよびセレノリラキシン各種の構造解析から合成したいずれのセレノリラキシンも野生型のリラキシンと同等の構造を有することが示唆されました。
成果2:セレノリラキシンの子宮内膜症治療薬としての可能性
以前の我々の研究で、子宮内膜症患者由来の子宮内膜間質細胞にはリラキシンの受容体*8であるロイシンリッチGタンパク質共役型レセプター7(LGR-7)が遍在していること、リラキシンが子宮内膜症の抑制製剤として機能し得ることを見出しています。すなわち、効率よく合成されたセレノリラキシンも同様の効果を示すか否かは興味深いところです。ここでは、子宮内膜間質細胞に対する合成セレノリラキシンの機能について、プラスミノーゲン活性化抑制因子1(PAI-1)の発現抑制効果に焦点を当てて検討しました。
PAI-1は、組織の線維化において重要な役割を果たし、子宮内膜症患者の腹腔内液中の高濃度のPAI-1は、腹膜病変*9の発生に寄与していることが示唆されています。PAI-1のmRNAの発現量は、合成リラキシン(100 ng/mL)で処理したすべてのグループにおいて、有意な減少を観測しました〔図4〕。特筆すべきは、2種のセレノリラキシンは野生型のリラキシンよりも効果的にPAI-1 mRNAの発現を抑制したことです。また、低濃度(33 ng/mL)におけるセレノリラキシンβは、この測定において最も高い有効性を示しました。これらの結果は、PAI-1の生産抑制という観点からセレノリラキシンの高い子宮内膜症抑制効果の可能性を示唆しています。
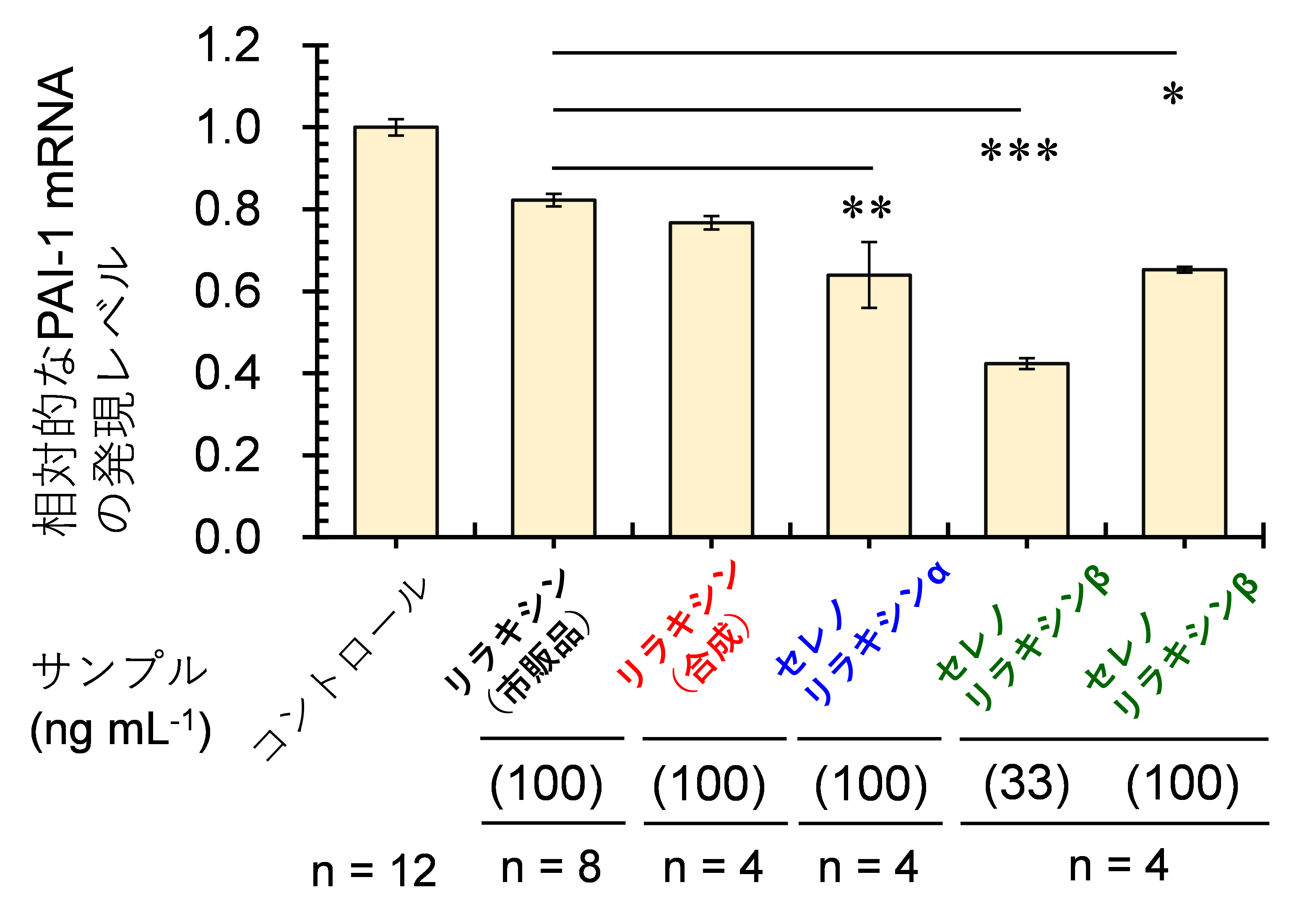
〔図4〕 相対的なPAI-1 mRNAの細胞内発現量の比較。患者由来の子宮内膜間質細胞を合成したリラキシンと共に培養すると、未処理(コントロール:相対値1.0)のものと比較して細胞内のPAI-1 mRNAの発現量が低下することを表している。
【まとめと今後の展開】
本研究によって、リラキシンが有するシステイン残基をセレノシステイン残基に置換する戦略が、そのカップリング効率だけでなく、薬剤としての生理学的機能を上方制御することがわかりました。今後、子宮内膜症治療薬としての利用に期待が高まります。また、合成した2種のセレノリラキシンが高いPAI-1発現抑制能を有することが明らかとなった一方で、その分子メカニズムについてはより詳細な解析が必要です。
今後は、セレノリラキシンとLGR-7との複合体形成に関する構造学的、物理化学的研究を進めることで、セレノリラキシンのPAI-1発現抑制能をさらに高めることができると期待されます。また、セレノリラキシンを子宮内膜症治療薬として実用化するため、セレノリラキシンのほかの子宮内膜症関連因子の発現抑制効果を総合的に検討するとともに、疾患モデル動物を用いた薬力学的、薬物動態学的検討を行う必要があると考えられます。加えて、セレノリラキシンの薬剤製剤応用を目指すうえで、前臨床試験における慎重な安全性評価も必要であると考えられます。
用語解説
ジスルフィド結合*1
タンパク質の構造安定化因子の一つ。アミノ酸の一種であるシステインはチオール(SH)基という硫黄(S)を含む部位を持ち、2つのSH基が酸化することでSS結合が形成される。
ジセレニド結合*2
システインの硫黄(S)原子がセレン(Se)原子に置き換わったアミノ酸(セレノシステイン)の間で形成される結合。ジスルフィド結合と酷似しているが、セレノール(SeH)基はSH基よりも反応性が著しく高いため、ポリペプチド鎖中でジセレニド結合はジスルフィド結合よりも早く形成される。また、ジセレニド結合はジスルフィド結合よりも切れにくく、安定的な性質を持っている。
子宮内膜症*3
子宮内膜組織が何らかの原因で、本来あるべき子宮の内側以外の場所で発生し、他の組織と癒着する疾患。20~30代の女性で発症することが多く、生理痛の悪化や慢性的な下腹部の痛み、排便および性行為時の痛みなどが主な症状である。不妊症の原因になることもある。
メッセンジャーRNA(mRNA)*4
タンパク質を作るために、どのアミノ酸をどのような順番で伸長させるかに関する情報がコードされた、いわばタンパク質の最終設計図に相当する一本鎖状の生体高分子。細胞内のmRNA量は最終的に生産されるタンパク質の量に相関することが多い。
ポリペプチド鎖*5
構成単位であるアミノ酸がペプチド結合と呼ばれる結合で多数連なった生体高分子の総称。創薬モダリティのターゲットとしても注目される。体内で、ある生理機能を果たしているポリペプチド鎖はタンパク質と呼ばれる。ゆえに、リラキシンもタンパク質の一種。アミノ酸は主に20種類存在し、これらの連なる順番や数によってポリペプチド鎖の構造と機能が制御される。
インスリン*6
膵臓のランゲルハンス島から分泌される、血糖値を降下させるペプチドホルモン。リラキシン同様、2種類のポリペプチド鎖(A鎖とB鎖)がジスルフィド結合によってカップリングした構造を有する。リラキシンとインスリンは極めて似た構造を有するが、その生理機能は全く異なる。
高速液体クロマトグラフィー(HPLC)*7
溶液中のポリペプチド鎖の成分分析法の一つ。A鎖とB鎖のカップリング中に生成される中間体の化学的性質の違いを利用して、それぞれを分離することが可能である。混合溶液をHPLCに注入すると、一定流速下で各成分が分離されて溶出時間に差が生じる。検出されたピーク面積から各成分を定量評価する(どのくらいの量が溶けているか見積もる)こともできる。
受容体*8
細胞外からやってくる様々なシグナル分子(神経伝達物質、ホルモン、その他生理活性物質など)を選択的に感受するタンパク質群。主に、細胞の表面(細胞膜)に存在する。
腹膜病変*9
腹部の消化管や肝臓などを全部または一部包み込んでいる膜(腹膜)の表面で起こる子宮内膜症性病変。
|
<本件に関するお問い合わせ>
(本資料の内容に関するお問い合わせ) 東海大学 理学部化学科 荒井堅太 TEL.0463-58-1211(直通) E-mail:ak5638@tokai.ac.jp
山梨大学 医学部産婦人科学講座 吉野修 TEL 055-273-9632(直通) E-mail:oyoshino@yamanashi.ac.jp
(広報に関するお問い合わせ) 東海大学 学長室広報担当 喜友名(きゆな)、林 TEL.0463-63-4670(直通)E-mail: pr@tsc.u-tokai.ac.jp
山梨大学 総務企画部 総務課 広報・渉外室 TEL.055-220-8005,8006 (直通) E-mail:koho@yamanashi.ac.jp |

