ここから本文です
トランスフェリン受容体阻害抗体がANKLがん細胞の増殖を抑制 ~肝障害を緩和、新たな治療薬として期待~
2023年06月07日
【研究発表】
トランスフェリン受容体阻害抗体がANKLがん細胞の増殖を抑制
~肝障害を緩和、新たな治療薬として期待~
東海大学[伊勢原キャンパス]医学部先端医療科学の幸谷愛教授は、宮竹佑治特任助教、亀田和明大学院研究学生(当時)、栁谷稜奨励研究員ら、および株式会社ペルセウスプロテオミクスと共に、JST戦略的創造研究推進事業において、アグレッシブNK細胞白血病(ANKL)注1)が肝臓の類洞毛細血管内で「トランスフェリン」(Tf)注2)に依存して増殖することを見いだし、またその受容体であるTfR1を特異的に阻害する抗体薬PPMX-T003がANKLに対して顕著な抗腫瘍活性を示すことを発見しました。
本研究成果は、これまで標準治療がなかったANKLの治療戦略を劇的に改善できる可能性を秘めており、2023年度から開始予定のANKL患者を対象とした医師主導治験(第Ⅰb/Ⅱ相試験)注3)は、多くの血液内科医や患者から注目を集めています。
本研究成果は、ANKL患者の検体提供(東北大学、秋田大学、名古屋市立大学)、次世代シークエンス解析 注4)(群馬大学、和歌山県立医科大学)などの点で多くの機関との共同研究によって得られました。
|
ポイント Ø ANKLは予後不良な血液がんであり、希少な疾患であることから標準治療は確立されていない。 Ø ANKLの患者由来異種移植マウスモデル(PDXマウス)注5)を樹立して解析し、ANKLのがん細胞は肝臓の中で、鉄を輸送するたんぱくTfに依存して増殖することを見いだした。 Ø ペルセウスプロテオミクス社が開発したヒト抗トランスフェリン受容体1(TfR1)阻害抗体(開発コード:PPMX-T003)は、ANKL PDXマウス内のがん細胞に対して強力な抗腫瘍活性と顕著な生存期間の延長を示し、ANKLに対する新たな治療薬となる可能性がある。 |
本研究成果は、米国血液学専門誌「blood」のオンライン版で公開されました。
|
本成果は、以下の事業・研究領域・研究課題によって得られました。 戦略的創造研究推進事業 チーム型研究(CREST) 研究領域:「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」 (研究総括:馬場 嘉信 名古屋大学 大学院工学研究科 教授) 研究課題名:「細胞外微粒子の1粒子解析技術の開発を基盤とした高次生命科学の新展開」 研究代表者:渡邊 力也(理化学研究所 開拓研究本部 主任研究員) 研究期間:令和元年10月~令和6年3月 JSTはこの領域で、細胞外微粒子に起因する生命現象の解明およびその理解に基づく制御技術の導出を目的とします。上記研究課題では、理学・工学・医学の異分野融合により、生体微粒子の組成や機能を1粒子ごとに網羅的に解析できる革新技術を開発します。
そのほか、以下の支援も受けています 日本医療研究開発機構(AMED) 次世代がん医療加速化研究事業 研究領域:領域B「がん生物学と異分野先端技術の融合をもとに新規モダリティの探索を含む創薬プラットフォームによるがん根治療法の研究」 分担研究課題名:「劇症型NK白血病に対する新規治療標的システイン-GGT系トランスフェリン (Tf)-T受容体系の作用機序解明」 研究分担代表者:幸谷 愛(東海大学 医学部 教授) 研究期間:令和4年~令和6年
日本学術振興会 科学研究費助成事業 基盤研究B 研究課題名:「急性NK白血病における主要微小環境解析」 研究代表者:幸谷 愛(東海大学 医学部 教授) 研究期間:令和2年~令和4年 |
■研究の背景と経緯
ANKLは若年に発症し、発症からの生存期間の中央値はわずか2か月弱と極めて予後不良な血液がんです。年間の発症者数は国内で平均10人前後と大変希少な疾患であり、いまだに標準治療は確立されていません。
いくつかの研究グループが、これまでのANKLの症例を解析してその治療成績をまとめた報告(後方視的解析)によると、ANKLの生存期間を延伸するには、同種造血幹細胞移植 注6)を速やかに実施し、かつ成功させることが必要です。移植を成功するためには、移植の前に実施する抗がん剤治療によってがん細胞を十分に減少させる必要がありますが、現状ではANKLに対して「比較的効果が認められる」とされている抗がん剤はL-アスパラギナーゼと呼ばれる薬剤のみです。
しかし、この薬剤には時に重篤な肝障害を引き起こすという欠点があります。ANKL患者の多くは、がん細胞によって肝臓に高度なダメージを受けており、治療に必要な量のL-アスパラギナーゼに耐えられない状態になっています。そのため、L-アスパラギナーゼを減量したり、使用そのものを断念したりしなければならず、十分にがん細胞を減少させることができないというジレンマがあります。
そこで、ANKLによる肝障害を克服し、移植前に必要な量のL-アスパラギナーゼを使用できる環境が整った新たな治療法が必要とされています。そのためには、単純にがん細胞を培地上で試験するだけではなく、実際に肝臓の中にあるがん細胞がどのような形で生存し、増殖しているのかを確認する必要があります。
近年、ヒトの体内におけるがん細胞と周囲の構造物との間で形成される分子の結合や物質のやり取りを解析する手法として、ヒトと同じ哺乳動物であるマウスの体内にヒトから採取したがん細胞を直接投与して増殖させる、PDXマウスというツールが発展してきました。多くの場合、PDXマウス内でのがん細胞の増殖や進展の様式はヒト体内と高度に類似することが分かっており、本研究グループはこの手法を用いてANKLのヒト体内、特に肝臓における生存様式を解析し、新薬の治療標的を探索する方針としました。
■研究の内容
まず、ANKL患者3名から採取されたがん細胞を、免疫機能(がん細胞のような異物を排除する能力)を高度に障害する遺伝子改変を施したマウス(免疫不全マウス)に移植し、ANKL PDXマウスを樹立しました。これらを由来となる患者ごとに、ANKL1、ANKL3、ANKL5と命名しました。これらのマウスを経時的に解剖して各臓器から細胞を抽出し、細胞表面の性質を調べることができるフローサイトメトリー法という技術を用いてがん細胞がどこにいるかを解析すると、がん細胞は初期には肝臓で生着・増殖し、後期に全身の臓器へ広がっていくことが判明しました(図1A)。
肝臓のがん細胞を顕微鏡にて観察すると、肝臓の中でも栄養分やミネラルなどを出し入れする部位である「類洞」と呼ばれる毛細血管の部分で特に増殖していることが分かりました(図1B)。このことから本研究では、ANKLという血液がんは、肝臓でやり取りされている何らかの物質に依存して増殖しているのではないかという仮説を立てました。
続いて、がん細胞と周囲の肝臓の細胞がそれぞれどのような分子を発現・分泌しているかを次世代シークエンサーの技術を用いて網羅的に調べ、その中で肝臓とがん細胞の間で分子同士の結合や物質のやり取りが行われている可能性のある「ペア」を検索しました(図2A)。
その結果、肝臓側で発現するTfと、それを受け取るANKL側の受容体分子であるTfR1のペアが上位にヒットしました(図2B)。Tfは細胞の増殖や生存に必須の元素である鉄イオンを運搬する輸送体たんぱくであり、主としてTfR1と結合することで細胞内に取り込まれます。特に、Tfは全身の各臓器の中でも肝臓で最も多く作られていることから、ANKLのがん細胞が肝臓類洞内で特に増殖する理由の1つとして、Tf-TfR1のペアを介した鉄イオンの供給を受ける必要があるためと分かりました。
実際に、CRISPR-Cas9系 注7)を用いてANKLのがん細胞側に発現するTfR1をノックアウト(無効化)して、ANKL PDXマウスを樹立したところ、がん細胞が肝臓内での増殖活性を著しく失うことが分かり(図2C)、ANKLは肝臓類洞内で、肝臓側からTfを受け取ることで増殖可能となることが確認されました。
そこで、すでにTfR1に対する阻害抗体を作成していたペルセウスプロテオミクス社(PPMX社)へ共同研究を打診し、実際に阻害抗体PPMX-T003がANKLに対して有効な治療薬となり得るかを検討しました。まず、ANKL患者3名に由来するがん細胞を、PPMX-T003を含んだ培地中で48時間培養し、生存細胞を測定しました。その結果、がん細胞の生存能はPPMX-T003の濃度に依存して低下することが判明しました(図3A)。
次に、樹立後7日目のPDXマウスに対してPPMX-T003を単回静脈内投与し、その後1週間でがん細胞の増殖度合いを、採血によって白血球中のがん細胞割合を見ることで評価しました。その結果、がん細胞は3ミリグラム/キログラム以上のPPMX-T003を投与したときに顕著にその増殖能の低下を示すことが観察されました(図3B)。
最後に、実際の治療を想定してPPMX-T003をANKL PDXマウスに複数回静脈内投与し、生存期間に差があるかを検討しました。その結果、本研究グループが樹立したANKL PDXマウスの全てにおいて、治療を行ったマウスは約1.5~2倍の生存期間の延伸を認めました(図4A)。この生存期間の延伸効果は、より症状の進んだANKL PDXマウス(樹立後14日目)に対して治療を開始しても同様の効果を得ることができました。
続いて、PPMX-T003による治療前後で肝臓内のがん細胞の量がどのように変容するかを、ホタルルシフェラーゼ遺伝子(ホタルの光のもとになる遺伝子)を導入したANKL1細胞で樹立したPDXマウスを用いて定量しました。その結果、治療前には肝臓の部位に顕著に発光が認められていましたが、治療を行うと速やかにその発光が消退することが示され、PPMX-T003は肝臓で増殖するANKLのがん細胞に対して極めて良好な抗腫瘍活性を示すことが判明しました(図4B)。
■今後の展開
以上の結果から、ANKLの患者が高度な肝障害を発症する要因として、肝臓こそがANKLのがん細胞の増殖の場であり、そこにはTf-TfR1の相互作用が強く関わっていること、そしてその相互作用を阻害することができるPPMX-T003はANKLに対する新規治療薬としてのポテンシャルを持つことが分かりました。
特に、発病初期に同薬を用いてANKLのがん細胞と肝臓の連関を断ち切ることによって肝臓を保護することができれば、引き続いて十分な量のL-アスパラギナーゼを含んだ抗がん化学療法をためらいなく行うことが可能となり、結果として同種造血幹細胞移植の前に十分に腫瘍細胞量を減少させ、治療成績の大幅な改善につながることが期待されます。
本研究グループは、この成果に基づいて、2023年度中に東海大学、東北大学、岡山大学、京都大学、九州大学および広島大学においてANKL患者を対象としたPPMX-T003の有効性と安全性を検討する医師主導治験(第Ⅰb/II相試験)を開始する予定です。今後はこの医師主導治験を滞りなく進めていくとともに、ANKLの鉄依存度の高さを裏付ける病態生理について、さらなる解析を進めていきます。
■参考図
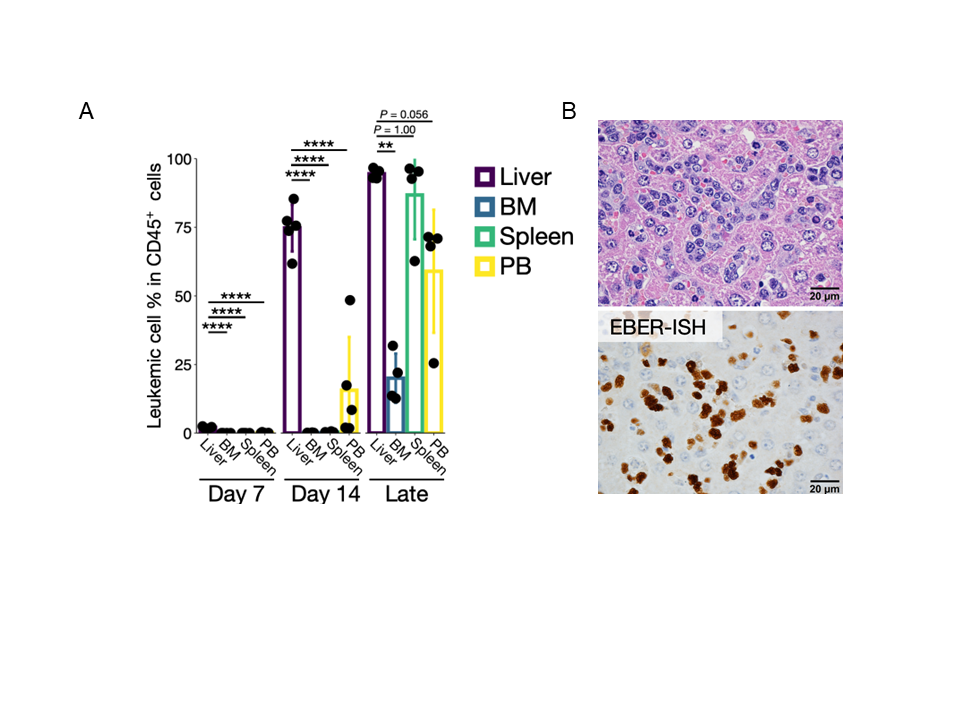
図1:ANKLのがん細胞は主として肝臓類洞内で増殖する
(A)ANKL1のPDXマウス樹立後の日数と、各臓器に存在する腫瘍細胞量。がん細胞は最初に肝臓(Liver)で増殖し、その後全身の各臓器(骨髄;BM、脾臓;Spleen、末梢血;PB)に広がっていくことが分かった。(B)ANKL1の肝臓の顕微鏡所見。上は一般的な染色で、下はANKLのがん細胞をEBERと呼ばれる核酸分子を染める(EBER-ISH)ことで、茶色に標識したもの。ANKLは肝細胞の間を網目状にめぐる類洞と呼ばれる毛細血管内で増殖することが分かった。
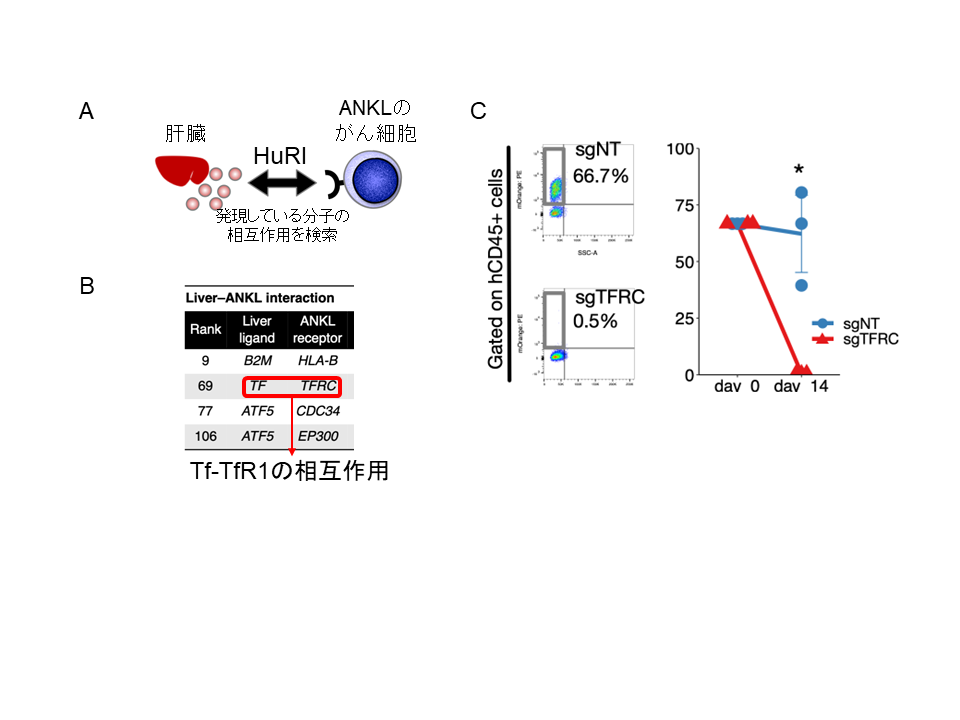
図2:ANKLのがん細胞は肝臓から分泌されるTfに依存して増殖する
(A、B)次世代シークエンサーによって肝臓とANKL1のがん細胞それぞれが発現している分子を網羅的に解析し、それらの中で分子同士が結合する「ペア」をHuRI(Human reference interactome)と呼ばれるデータベースを用いて抽出した。この中で、治療標的となり得る分子について絞り込みを行ったところ、Tf-TfR1の分子結合が同定された。(C)TfR1をノックアウトしたANKL1細胞(sgTFRC)は、ノックアウトされていない細胞(sgNT)と比較して肝臓内で増殖する腫瘍細胞の割合が著しく低下した。
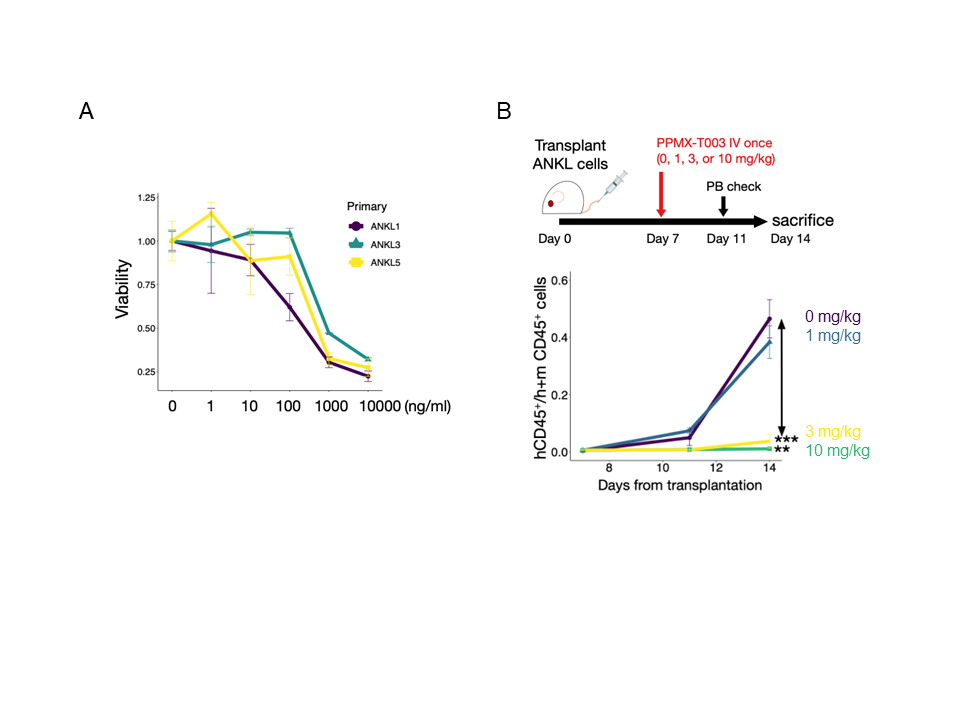
図3:PPMX-T003はANKLのがん細胞の増殖を濃度依存的に抑制する
(A)3つのANKL患者由来細胞を培地中でPPMX-T003存在下で培養し、48時間後の生存細胞数を測定した。いずれの細胞も濃度依存性に生存能が低下することが示された。(B)ANKL1 PDXマウスに対して樹立後7日目にPPMX-T003を単回静脈内投与し、樹立後11日目、14日目に採血を行い、白血球中のがん細胞の割合を測定した。PPMX-T003 3ミリグラム/キログラム以上の投与によってがん細胞の量は著減することが示された。
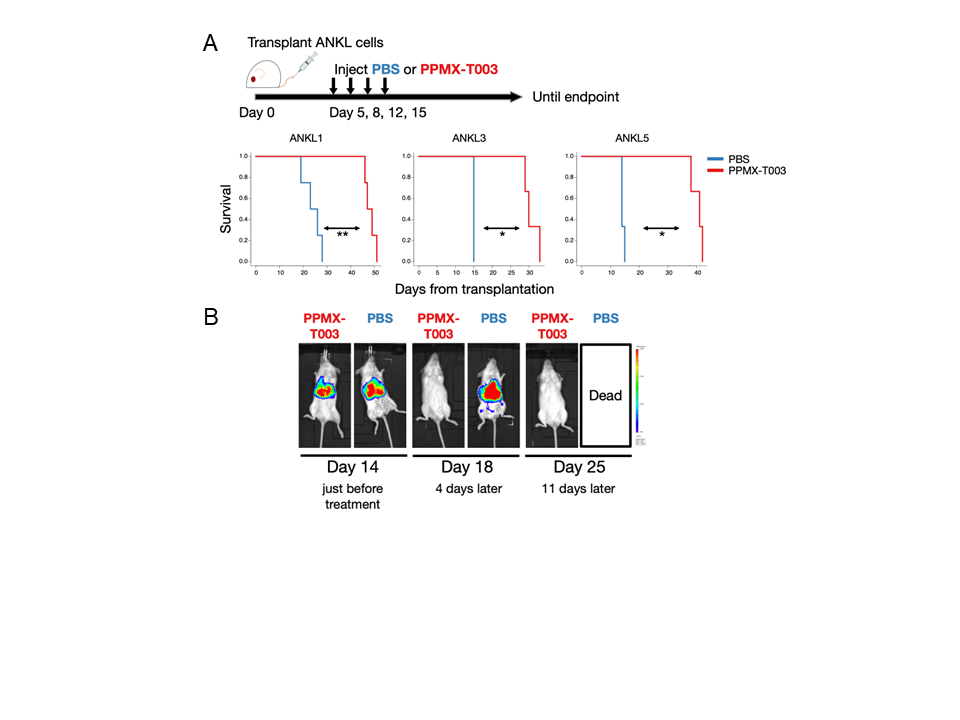
図4:PPMX-T003によってANKL PDXマウスの肝臓からがん細胞が消退し、生存期間が延伸した
(A)3つのANKL PDXマウスに対してPPMX-T003または有効成分の入っていない緩衝液(PBS)を樹立後5、8、12、15日目に、各10ミリグラム/キログラムを静脈内投与して生存期間を解析した。その結果、PPMX-T003による治療群(赤)は未治療群(青)と比較して顕著に生存期間が延伸することが判明した。(B)ホタルルシフェラーゼ遺伝子を導入したANKL1細胞を用いて、がん細胞を発光させた状態でPPMX-T003 10ミリグラム/キログラムの静脈内投与による治療をPDXマウス樹立後14日目、17日目、21日目、24日目に行い、経時的にがん細胞の量を確認した。投与後速やかに肝臓からがん細胞を示す発光は消退した。
■用語解説
注1)アグレッシブNK細胞白血病(Aggressive NK cell leukemia;ANKL)
血液がんの一種。ナチュラルキラー細胞(Natural killer cell;NK cell)と呼ばれるリンパ球の一種ががん化したもの。
注2)トランスフェリン(Transferrin;Tf)
Tfは、細胞の生命活動に必須の元素である鉄イオンを体中の臓器へ届けるための輸送たんぱくである。Tfの受容体であるトランスフェリン受容体1(Transferrin receptor1;TfR1)は、鉄イオンを受け取る細胞がその表面に発現するたんぱくであり、鉄イオンを運んでいるTfがTfR1に結合すると、TfR1はTfごと細胞内へ取り込まれ、鉄イオンを受け取る。
注3)医師主導治験
新薬のヒトに対する安全性と有効性を確かめる試験(治験)を、製薬会社ではなく医師が主導して行うもの。通常全部で3つのフェーズに分けられ、第Ⅰ相では主として安全性や薬物動態、第Ⅱ相では患者に対する有効性、第Ⅲ相では既存の治療薬による治療との比較(二重盲検無作為化比較試験)を行う。
注4)次世代シークエンサー
サンプル中の細胞に存在する遺伝子変異や、それぞれの遺伝子がどのように発現しているかといった情報を、網羅的に(全ゲノムレベルで)解析できる技術。今回の解析では、がん細胞と肝臓の細胞がどのような遺伝子を発現しているかという情報について、次世代シークエンサーの中でも「RNAseq」という手法を用いて解析した。
注5)患者由来異種移植マウス(Patient-derived xenograft mouse;PDXマウス)
患者から採取した腫瘍細胞を、あらかじめ免疫機能(外から入り込んだ異物を排除する機能)を排除するための特別な遺伝子操作を行ったマウス(免疫不全マウス)に投与(今回の場合は静脈注射)することで樹立する。患者の腫瘍はマウスの体内で、患者の体内での増殖や進展様式を高度に再現することができ、より詳細な腫瘍細胞と周囲の構造体との相互作用を解析することが可能となる。
注6)同種造血幹細胞移植
一般的には「骨髄移植」という言葉で知られる。多くの血液がんを根治せしめる治療法。あらかじめ致死量の放射線照射や大量の抗がん剤治療を行うことにより、自分の血を作る細胞(造血幹細胞)を死滅させ、その状態で健康なドナーの造血幹細胞を投与し、がんを発症するような異常のないきれいな血を作る能力を獲得する治療。一方で合併症も多く、移植前に十分に病勢をコントロールできなければ成功率は低下する。
注7)CRISPR-Cas9系
大腸菌が持つ免疫機構を基盤とした遺伝子改変技術。もともとは大腸菌の菌体内に侵入したウイルスなどの遺伝子を、それを認識する小ガイドRNAに誘導されたカスパーゼ9 (Cas9)という核酸分解酵素が分解するシステムを指す。このシステムを応用して、対象の遺伝子(今回はTfR1をコードするTFRC遺伝子)を認識する小ガイドRNAとCas9を同時に細胞内(今回はANKLがん細胞)に導入することで、対象遺伝子(TFRC遺伝子)にダメージ(変異)を与え、遺伝子発現ができないノックアウト細胞を作ることができる。
■論文タイトル
"Hepatic niche leads to aggressive natural killer cell leukemia proliferation through transferrin-transferrin receptor 1 axis"
(肝臓微小環境は、トランスフェリン-トランスフェリン受容体1の相互作用を介してアグレッシブNK細胞白血病の増殖を誘導する)
|
<研究に関するお問い合わせ> 東海大学医学部医学科先端医療科学 幸谷 愛 TEL. 0463-93-1121(内線2781)Email:aikotani@k-lab.jp
<本件に関するお問い合わせ> 東海大学 学長室広報 担当:喜友名 TEL.0463-63-4670(直通) E-mail:pr@tsc.u-tokai.ac.jp |

