ここから本文です
東海大学、東北大学、大阪大学の共同研究グループ 新規人工インスリン「セレノインスリン」の化学合成と機能解明に成功~体内での薬効が長時間持続する新規インスリン製剤への応用に期待~
2017年04月11日
東海大学理学部化学科講師の荒井堅太および同学科教授の岩岡道夫、ならびに東北大学学際科学フロンティア研究所(多元物質科学研究所兼任)助教の奥村正樹、多元物質科学研究所の渡部聡および同研究所(生命科学研究科および理学研究科化学専攻兼任)教授の稲葉謙次、大阪大学蛋白質研究所教授の北條裕信らの研究グループは、天然のインスリン(ウシ膵臓由来)に含まれるジスルフィド結合*1の一つをジセレニド結合*2に置換した新規人工インスリン「セレノインスリン」の化学合成に成功いたしました。これにより、糖尿病治療において、体内での薬効が長時間持続する新規インスリン製剤としての応用が期待されます。
なお、本研究成果は、4月10日(月)付でドイツの国際化学誌「Angewandte Chemie International Edition」電子版に掲載されました。
https://doi.org/10.1002/anie.201701654
https://twitter.com/angew_chem/status/851495297465372672
DOI: 10.1002/anie.201701654
■本研究成果のポイント
◇セレン原子の高い反応性を利用した効率的な新規人工インスリン「セレノインスリン」の化学合成法を確立した。
◇「セレノインスリン」は天然のインスリンと同等の立体構造と生物活性を持つ。
◇「セレノインスリン」は体内に存在するインスリン分解酵素(IDE)*3に対して高い分解耐性(分解するまでの時間が長い)を示す。体内で長時間にわたり循環・作用する新しいタイプの持効型インスリン*4の応用に期待される。
【研究成果の概要】
本研究グループは、天然のインスリン(ウシ膵臓由来)に含まれるジスルフィド結合の一つをジセレニド結合に置換した新規人工インスリン「セレノインスリン」の化学合成に成功しました。今回、化学合成に成功した「セレノインスリン」は、その立体構造と生理活性が天然のインスリンと同等である一方、体内に存在するインスリン分解酵素(IDE)に対して顕著な分解耐性(分解するまでの時間が長い)を示すことが明らかになりました。これにより、糖尿病治療において、体内での薬効が長時間持続する新規インスリン製剤としての応用が期待されます。
本研究は、東海大学理学部化学科と東北大学多元物質科学研究所、大阪大学蛋白質研究所が共同で実施した成果です。また、研究を実施するにあたり、文部科学省科学研究費助成事業(東海大学)、公益財団法人武田科学振興財団(東北大学)、公益財団法人上原記念生命科学財団(東北大学)、国立研究開発法人科学技術振興機構CREST(東北大学)より資金援助をいただいております。
【研究の背景】
糖尿病患者は、世界規模で爆発的に増えており、世界保健機関(WHO)の発表によると、世界の成人の糖尿病患者数は2014年までに4億人を超えています。糖尿病患者にとって、インスリン製剤は命をつなぐ唯一の薬剤である一方、高頻度での皮下投与は肉体的・精神的な負担が大きいのも事実です。創薬分野では、こうした患者の負担をできるだけ軽減しようと、長時間にわたって体内で循環・作用し、インスリンの基礎分泌を補助する新規持効型インスリン製剤の開発が大きな課題の一つとなっています。
投与後に血流によって体内を循環したインスリンは、最終的に腎臓内でインスリン分解酵素(Insulin Degrading Enzyme; IDE)によって分解され尿として排出されます。本研究にあたっては、このIDEに対して高い分解耐性を示すインスリンを人工的に作成することができれば、長時間体内を循環する新しいタイプの持効型インスリン製剤の開発につながるものと考えました。
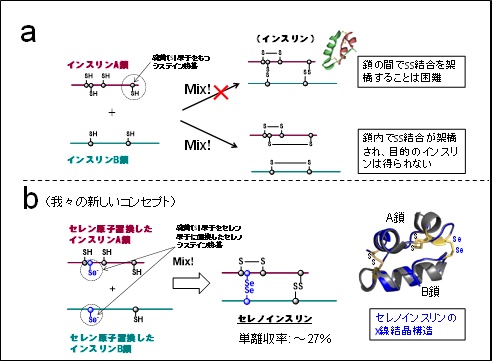
一方、インスリンは二本の異なるポリペプチド鎖*5のA鎖およびB鎖が、硫黄(S)原子同士のジスルフィド(SS)結合によって安定化されており〔図1-a〕、A鎖とB鎖からインスリンを得ようとしても鎖内のSS結合が優先して機能してしまうため、本来の目的のインスリンはほとんど得られません。そこで、我々の研究チームは、Sよりもさらに反応性に富んだセレン(Se)原子に着目し、SをSeに置き換えたインスリンA鎖およびB鎖を用いれば、迅速に鎖間でジセレニド(SeSe)結合が形成されるため、両ペプチド鎖の会合反応を効率的に行えるのではないかと仮説を立てました。さらに、SeSe結合はSS結合よりも安定しており、インスリン分子に対して立体構造の“硬さ”と、それに起因するIDE分解耐性を同時に付与できるものと予想しました。このようなコンセプトのもと、まずはSe含有インスリンA鎖およびB鎖の化学合成に着手し、それらを得ることに成功しました〔図1-b〕。さらに各ペプチド鎖を最適な条件下で混合し反応させることで、目的の「セレノインスリン」を最大27%の単離収率で得ることに成功しました。
次に、X線結晶構造解析によって、「セレノインスリン」の三次元立体構造を解析したところ、人工の「セレノインスリン」は天然インスリンと同様の立体構造を有していることが明らかとなりました。これは「セレノインスリン」が天然インスリンと同等の生理活性をもつことを示唆しています。
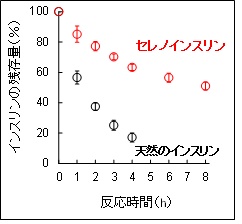
そこで、「セレノインスリン」による細胞刺激応答*6を観測し、その生理活性を評価したところ、「セレノインスリン」は“インスリン”としての生理機能を保持していることを確認しました。さらにIDEを用い、天然インスリンおよび「セレノインスリン」の分解実験を行ったところ、「セレノインスリン」は天然インスリンよりも分解速度が著しく遅いことがわかりました〔図2〕。これは、SeSe結合自身の安定性に加えて、IDEが認識しているインスリンの局所構造が「セレノインスリン」ではごくわずかに変形していることに起因しているものと考えられます。
このような結果から、「セレノインスリン」は体内での薬効が長時間持続すると考えられ、新規持効型インスリン製剤としての応用が期待されます。
【用語解説】
◇インスリン製剤
膵臓の中に島状に散在し、内分泌機能を果たす細胞群であるランゲルハンス島から分泌される血糖抑制に関わるタンパク質であり、糖尿病患者はインスリン分泌がうまくいかず、皮下注射によってインスリン製剤を投与する必要がある。インスリン製剤の合成では、①生合成機構を模倣し、A鎖とB鎖をリンカーペプチドで連結し、ジスルフィド結合を架橋後、リンカー部位を切除する方法、②複数の保護基でシステインチオール基を保護し、段階的な脱保護と鎖間のジスルフィド架橋を行う化学的手法、の主に2つの複雑な合成戦略が用いられてきた。
◇*1 ジスルフィド(SS)結合
タンパク質の構造安定化因子の一つ。アミノ酸の一種であるシステインはチオール(SH)基という硫黄(S)を含む部位をもち、2つのSH基が酸化することでSS結合が形成される。
◇*2 ジセレニド(SeSe)結合
システインの硫黄(S)原子がセレン(Se)原子に置き換わったアミノ酸(セレノシステイン)の間で形成される結合。SS結合と酷似しているが、SeH基はSH基よりも反応性が著しく高いため、ポリペプチド鎖中でSeSe結合はSS結合よりも早く形成される。また、SeSe結合はSS結合よりも切れにくく、安定的な性質を持っている。
◇*3 インスリン分解酵素(IDE)
腎臓や肝臓に主に分布する酵素で、健常者においては過剰分泌されたインスリンを分解する働きを持つ。
◇*4 持効型インスリン製剤
インスリン製剤には大きく分けて、食後の急激な血糖上昇を制御するための即効型インスリンと定常のインスリン基礎分泌を補う持効型インスリンの2種類が存在する。従来の持効型インスリンでは、皮下で不溶解性沈殿を形成させることで、ゆっくりと血中に吸収させる方法や、皮下や血中のアルブミンに吸着させることで、皮下から血中への吸収だけでなく血中から組織への分泌を遅延させるなどの工夫が講じられてきた。
◇*5 ポリペプチド鎖
構成単位であるアミノ酸がペプチド結合とよばれる結合で多数連なった生体高分子の総称。体内で、ある生理機能を果たしているポリペプチド鎖はタンパク質と呼ばれる。ゆえに、インスリンもタンパク質の一種。アミノ酸は主に20種類存在し、これらの連なる順番や数によってポリペプチド鎖の構造と機能が制御されている。
◇*6 細胞刺激応答
インスリンによる細胞刺激では、細胞表面のInsulin receptorからIRS1 → PI3K → PIP3 → PDK1 → Akt → GSK3bというリン酸化シグナル伝達を引き起こすことがよく知られている。そこで、天然のインスリンと「セレノインスリン」を用いて細胞刺激を行った際の、AktとGSK3bの リン酸化状態を評価することで、「セレノインスリン」が天然インスリンと同等の生理活性を有しているか否かを評価することができる。
■本件に関するお問い合わせ
学校法人東海大学 経営企画室広報課
TEL:03-3467-2211(代表)
FAX:03-3485-4939
mail:pr@tokai.ac.jp
なお、本研究成果は、4月10日(月)付でドイツの国際化学誌「Angewandte Chemie International Edition」電子版に掲載されました。
https://doi.org/10.1002/anie.201701654
https://twitter.com/angew_chem/status/851495297465372672
DOI: 10.1002/anie.201701654
■本研究成果のポイント
◇セレン原子の高い反応性を利用した効率的な新規人工インスリン「セレノインスリン」の化学合成法を確立した。
◇「セレノインスリン」は天然のインスリンと同等の立体構造と生物活性を持つ。
◇「セレノインスリン」は体内に存在するインスリン分解酵素(IDE)*3に対して高い分解耐性(分解するまでの時間が長い)を示す。体内で長時間にわたり循環・作用する新しいタイプの持効型インスリン*4の応用に期待される。
【研究成果の概要】
本研究グループは、天然のインスリン(ウシ膵臓由来)に含まれるジスルフィド結合の一つをジセレニド結合に置換した新規人工インスリン「セレノインスリン」の化学合成に成功しました。今回、化学合成に成功した「セレノインスリン」は、その立体構造と生理活性が天然のインスリンと同等である一方、体内に存在するインスリン分解酵素(IDE)に対して顕著な分解耐性(分解するまでの時間が長い)を示すことが明らかになりました。これにより、糖尿病治療において、体内での薬効が長時間持続する新規インスリン製剤としての応用が期待されます。
本研究は、東海大学理学部化学科と東北大学多元物質科学研究所、大阪大学蛋白質研究所が共同で実施した成果です。また、研究を実施するにあたり、文部科学省科学研究費助成事業(東海大学)、公益財団法人武田科学振興財団(東北大学)、公益財団法人上原記念生命科学財団(東北大学)、国立研究開発法人科学技術振興機構CREST(東北大学)より資金援助をいただいております。
【研究の背景】
糖尿病患者は、世界規模で爆発的に増えており、世界保健機関(WHO)の発表によると、世界の成人の糖尿病患者数は2014年までに4億人を超えています。糖尿病患者にとって、インスリン製剤は命をつなぐ唯一の薬剤である一方、高頻度での皮下投与は肉体的・精神的な負担が大きいのも事実です。創薬分野では、こうした患者の負担をできるだけ軽減しようと、長時間にわたって体内で循環・作用し、インスリンの基礎分泌を補助する新規持効型インスリン製剤の開発が大きな課題の一つとなっています。
投与後に血流によって体内を循環したインスリンは、最終的に腎臓内でインスリン分解酵素(Insulin Degrading Enzyme; IDE)によって分解され尿として排出されます。本研究にあたっては、このIDEに対して高い分解耐性を示すインスリンを人工的に作成することができれば、長時間体内を循環する新しいタイプの持効型インスリン製剤の開発につながるものと考えました。
一方、インスリンは二本の異なるポリペプチド鎖*5のA鎖およびB鎖が、硫黄(S)原子同士のジスルフィド(SS)結合によって安定化されており〔図1-a〕、A鎖とB鎖からインスリンを得ようとしても鎖内のSS結合が優先して機能してしまうため、本来の目的のインスリンはほとんど得られません。そこで、我々の研究チームは、Sよりもさらに反応性に富んだセレン(Se)原子に着目し、SをSeに置き換えたインスリンA鎖およびB鎖を用いれば、迅速に鎖間でジセレニド(SeSe)結合が形成されるため、両ペプチド鎖の会合反応を効率的に行えるのではないかと仮説を立てました。さらに、SeSe結合はSS結合よりも安定しており、インスリン分子に対して立体構造の“硬さ”と、それに起因するIDE分解耐性を同時に付与できるものと予想しました。このようなコンセプトのもと、まずはSe含有インスリンA鎖およびB鎖の化学合成に着手し、それらを得ることに成功しました〔図1-b〕。さらに各ペプチド鎖を最適な条件下で混合し反応させることで、目的の「セレノインスリン」を最大27%の単離収率で得ることに成功しました。
次に、X線結晶構造解析によって、「セレノインスリン」の三次元立体構造を解析したところ、人工の「セレノインスリン」は天然インスリンと同様の立体構造を有していることが明らかとなりました。これは「セレノインスリン」が天然インスリンと同等の生理活性をもつことを示唆しています。
そこで、「セレノインスリン」による細胞刺激応答*6を観測し、その生理活性を評価したところ、「セレノインスリン」は“インスリン”としての生理機能を保持していることを確認しました。さらにIDEを用い、天然インスリンおよび「セレノインスリン」の分解実験を行ったところ、「セレノインスリン」は天然インスリンよりも分解速度が著しく遅いことがわかりました〔図2〕。これは、SeSe結合自身の安定性に加えて、IDEが認識しているインスリンの局所構造が「セレノインスリン」ではごくわずかに変形していることに起因しているものと考えられます。
このような結果から、「セレノインスリン」は体内での薬効が長時間持続すると考えられ、新規持効型インスリン製剤としての応用が期待されます。
【用語解説】
◇インスリン製剤
膵臓の中に島状に散在し、内分泌機能を果たす細胞群であるランゲルハンス島から分泌される血糖抑制に関わるタンパク質であり、糖尿病患者はインスリン分泌がうまくいかず、皮下注射によってインスリン製剤を投与する必要がある。インスリン製剤の合成では、①生合成機構を模倣し、A鎖とB鎖をリンカーペプチドで連結し、ジスルフィド結合を架橋後、リンカー部位を切除する方法、②複数の保護基でシステインチオール基を保護し、段階的な脱保護と鎖間のジスルフィド架橋を行う化学的手法、の主に2つの複雑な合成戦略が用いられてきた。
◇*1 ジスルフィド(SS)結合
タンパク質の構造安定化因子の一つ。アミノ酸の一種であるシステインはチオール(SH)基という硫黄(S)を含む部位をもち、2つのSH基が酸化することでSS結合が形成される。
◇*2 ジセレニド(SeSe)結合
システインの硫黄(S)原子がセレン(Se)原子に置き換わったアミノ酸(セレノシステイン)の間で形成される結合。SS結合と酷似しているが、SeH基はSH基よりも反応性が著しく高いため、ポリペプチド鎖中でSeSe結合はSS結合よりも早く形成される。また、SeSe結合はSS結合よりも切れにくく、安定的な性質を持っている。
◇*3 インスリン分解酵素(IDE)
腎臓や肝臓に主に分布する酵素で、健常者においては過剰分泌されたインスリンを分解する働きを持つ。
◇*4 持効型インスリン製剤
インスリン製剤には大きく分けて、食後の急激な血糖上昇を制御するための即効型インスリンと定常のインスリン基礎分泌を補う持効型インスリンの2種類が存在する。従来の持効型インスリンでは、皮下で不溶解性沈殿を形成させることで、ゆっくりと血中に吸収させる方法や、皮下や血中のアルブミンに吸着させることで、皮下から血中への吸収だけでなく血中から組織への分泌を遅延させるなどの工夫が講じられてきた。
◇*5 ポリペプチド鎖
構成単位であるアミノ酸がペプチド結合とよばれる結合で多数連なった生体高分子の総称。体内で、ある生理機能を果たしているポリペプチド鎖はタンパク質と呼ばれる。ゆえに、インスリンもタンパク質の一種。アミノ酸は主に20種類存在し、これらの連なる順番や数によってポリペプチド鎖の構造と機能が制御されている。
◇*6 細胞刺激応答
インスリンによる細胞刺激では、細胞表面のInsulin receptorからIRS1 → PI3K → PIP3 → PDK1 → Akt → GSK3bというリン酸化シグナル伝達を引き起こすことがよく知られている。そこで、天然のインスリンと「セレノインスリン」を用いて細胞刺激を行った際の、AktとGSK3bの リン酸化状態を評価することで、「セレノインスリン」が天然インスリンと同等の生理活性を有しているか否かを評価することができる。
■本件に関するお問い合わせ
学校法人東海大学 経営企画室広報課
TEL:03-3467-2211(代表)
FAX:03-3485-4939
mail:pr@tokai.ac.jp