ここから本文です
【研究発表】東海大学、東北大学、大阪大学、韓国KBSIの国際共同研究グループ セレノインスリンの高効率な化学合成を実現、持効性の発現も確認 ~持効型インスリン製剤開発の新たな戦略を提案~
2023年12月05日
東海大学理学部化学科講師の荒井堅太(同大学先進生命科学研究所兼務)および同学科教授の岩岡道夫(同大学先進生命科学研究所長兼務)、東北大学学際科学フロンティア研究所准教授の奥村正樹、多元物質科学研究所教授の稲葉謙次、大阪大学蛋白質研究所教授の北條裕信、韓国基礎科学支援研究院(略称KBSI)バイオ融合研究部教授の李映昊らで構成される国際共同研究グループは、インスリンを構成する2本の異なるポリペプチド鎖*1(A鎖およびB鎖)の間に形成され分子表面に露出したジスルフィド結合*2の硫黄原子をセレン原子に置換した人工インスリン(セレノインスリン*3)の化学合成を高効率化させることに成功しました。
さらに、セレノインスリンが可溶性の分子集合体を形成することでインスリン分解酵素(IDE)*4による分解を受けにくくなっていることを突き止め、セレノインスリンが通常のインスリンよりも長時間にわたって薬理効果(血糖降下作用)を発揮することを明らかにしました。本研究は、インスリンの分子表面を化学的に修飾して体内での自己組織化を促すことでインスリンに分解酵素耐性を付与するという、新たな持効型製剤の設計指針を提案するものです。
なお、本研究成果は、11月21日(火)付でイギリスの国際化学誌『Communications Chemistry』電子版に掲載されました。
|
■本研究成果のポイント ◇ セレノシステインをシステインの代わりに導入したインスリンの構成ポリペプチド鎖(A鎖とB鎖)を混合することで、ワンステップでセレノインスリンを高効率(72%)で合成することに成功した。 ◇ セレノインスリンは野生型インスリンよりも低濃度で可溶性の二量体や六量体を形成した。 ◇ インスリンの多量体は、セレノインスリン同士の間だけでなく、セレノインスリンと野生型インスリンの間でも形成された。これらの多量体は、インスリン分解酵素による分解を受けにくいことが確認された。 ◇ セレノインスリンを糖尿病モデルラットに投与したところ、血糖値抑制効果が通常のインスリンよりも長時間観測された。 ◇ インスリンの分子同士の自己組織化を促すことで分解を抑制しインスリンに持効性を持たせるという、持効型インスリン薬剤への新しい製剤戦略を提案する。 |
 |
 |
【研究の背景】
世界保健機関(WHO)の発表によると、世界の成人の糖尿病患者数は2021年までに5億3,700万人に達しており、現在では10人に1人が糖尿病有病者と推定されています。血糖値降下製剤として糖尿病患者が常用するインスリン製剤*5は現在、遺伝子組み換えを行った細胞を培養してインスリンを収穫し、これに化学的な修飾を加えることで製造されています。これに対して、生物の力に頼らずに化学反応だけを用いてインスリンを合成する技術開発も進められています(図1ab)。後者の化学合成法では、純度が高く品質の良いインスリンを合成できること、非天然アミノ酸を含むインスリン変異体の合成が容易であることなど、遺伝子組み換え法に比べて有利な点があります。
【研究の成果】
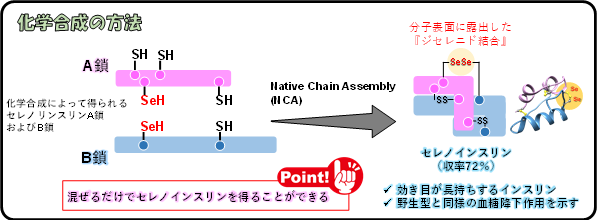
・インスリン類の化学合成を72%で達成
本研究の東海大学、東北大学、大阪大学のグループは、2017年にインスリンを構成する2本の異なるポリペプチド鎖(A鎖およびB鎖)の間に形成され分子表面に露出したジスルフィド結合の硫黄原子をセレン原子に置換した人工のインスリン(セレノインスリン)の化学合成に成功し、セレノインスリンがインスリン分解酵素(IDE)に対して分解耐性を示すことを報告しました。しかし、当時の合成収率は27%と低く、またセレノインスリンがIDEによって分解されにくい原因ははっきりしていませんでした。その後、同研究グループは野生型インスリンの化学合成の効率化を検討し、その結果2018年にインスリンの効率的な化学合成法(Native Chain Assembly; NCA法)*6を確立しました(図1c)。NCA法では、化学修飾のない天然のA鎖とB鎖を混合するだけで、インスリンを49%という良好な収率で得ることができます。
本研究では、NCA法の反応条件を適用することで、反応溶液中の化学修飾が施されていないセレノインスリンA鎖およびB鎖から72%という高収率かつワンステップで(混ぜるだけで)セレノインスリンを得ることに成功しました。この収率は、プロインスリン(A鎖とB鎖がつながった1本鎖のインスリン前駆体)からインスリンがつくられるときの収率に匹敵し、インスリン類の化学合成の収率としては極限に近いものと考えられます。
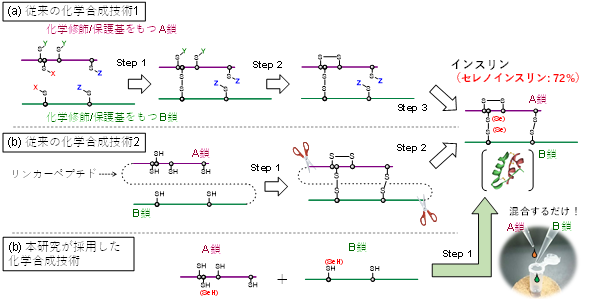 |
〔図1〕 インスリンの化学合成戦略。(a)多種類の保護基の選択的な脱保護とジスルフィド結合架橋によるインスリン調製。(b)プロインスリン様ペプチドのジスルフィド結合架橋とリンカーペプチドの切除によるインスリン調製。(c)本研究で採用したインスリンA鎖およびB鎖の自己組織化を利用した合成法。セレノインスリンの場合、最大収率は72%に達する。
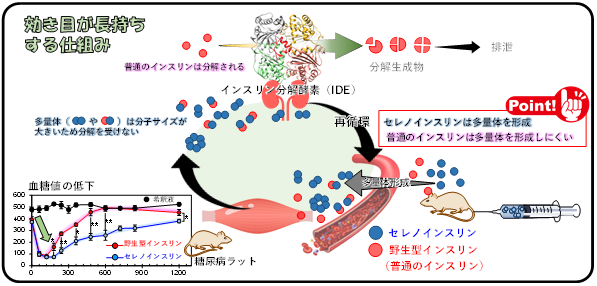
・セレノインスリンは野生型よりも酵素分解を受けにくいことを再確認
次に、合成したセレノインスリンのIDE耐性をセレノインスリンの濃度を変えて詳細に検討しました(図2a)。その結果、セレノインスリンは適用したすべての濃度条件において、野生型インスリンよりも高いIDE耐性を示すことが分かりました(図2b)。驚くべきことに野生型インスリンにセレノインスリンを混ぜると、野生型インスリンのIDE耐性がセレノインスリンと同程度に向上しました。IDEは単体のインスリンを反応ポケットに取り込むことでインスリンを分解することが知られていることから、セレノインスリンはそれ自身あるいは野生型インスリンとの間でも可溶性の多量体*7を形成し、インスリン各種のIDEによる分解を妨げているものと推察されます。
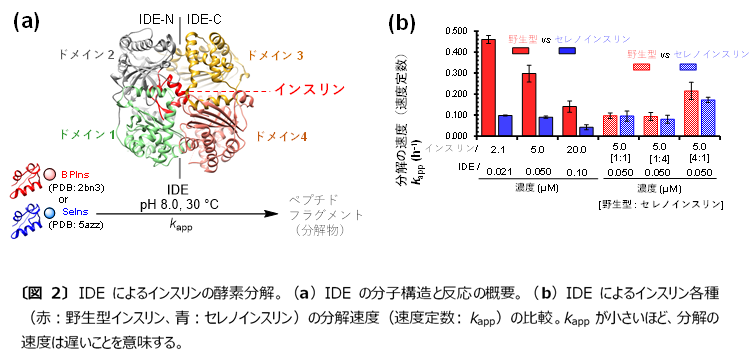 |
・セレノインスリンの多量体形成を観測
そこで、同研究グループはインスリンの多量体形成の詳細を調べるために、韓国KBSIの李教授の協力を得て、超遠心分析(AUC)法*8および円二色性(CD)分散計*9を用いて可溶性の多量体の形成挙動とその熱安定性を調査しました。AUC解析の結果、セレノインスリン(図3b)は野生型インスリン(図3a)に比べて低濃度で二量体や六量体を形成することが確認されました。さらに、セレノインスリンは野生型インスリンとも低濃度条件で同様の多量体を形成することが明らかになりました。(図3c)
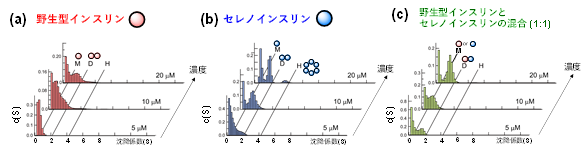 |
〔図3〕 分析的超遠心法(AUC)によって推定された野生型インスリン(a)、セレノインスリン(b)、およびそれらの混合溶液中(c)における単量体および多量体の見かけの沈降係数ヒストグラム。ピーク形状から各濃度における水溶液中の単量体(M)、二量体(D)、六量体(H)の組成比がわかる。
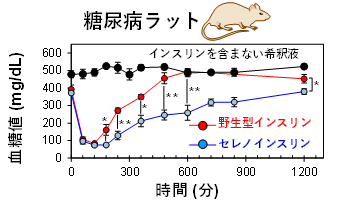
・セレノインスリンは血糖抑制効果を長時間持続した
|
|
|
〔図4〕 糖尿病モデルラットを用いたインスリン各種の血糖降下作用に関する動物試験(インスリン投与量 150 μg/300 gラット)。 |
このような分子メカニズムによってIDEによる分解を受けにくいセレノインスリンは、長時間にわたって体内に留まり、血糖値降下作用を長い時間持続するものと考えられます。そこで、インスリン各種を正常ラットおよび糖尿病ラットにそれぞれ皮下投与し、血糖値の変化をモニタリングしたところ、セレノインスリンは野生型インスリンよりも長時間にわたって血糖降下作用を持続させることが分かりました(図4)。
【今後の展望】
これまでの持効型インスリン製剤は、インスリンを凝集させることでインスリンの血液中への拡散を遅延させる戦略や、インスリンを別のタンパク質に結合させることで分解を抑制する戦略などが用いられてきました。本研究成果では、インスリンの分子表面を化学修飾して可溶性の多量体を形成させることでIDE分解を遅延させ、長時間の体内滞留を可能にすることで、長時間の薬理効果の発現を可能にしました。インスリンの基礎分泌を補う持効型インスリン製剤の開発において新しい設計概念を提案するものと期待されます。
【論文情報】
|
タイトル |
: |
Diselenide-bond replacement of the external disulfide bond of insulin increases its oligomerization leading to sustained activity |
|
論文誌 |
: |
『Communications Chemistry』電子版 |
|
掲載日 |
: |
2023年11月21日(火) |
|
著者 |
: |
荒井堅太(東海大学理学部化学科)、奥村正樹(東北大学学際科学フロンティア研究所)、Young-Ho Lee(韓国基礎科学支援研究院バイオ融合研究部)、片山秀和(東海大学工学部生物工学科)、水谷健二(横浜市立大学大学院生命医科学研究科)、Yuxi Lin(韓国基礎科学支援研究院バイオ融合研究部)、Sam-Yong Park(横浜市立大学大学院生命医科学研究科)、澤田佳一郎(東海大学医学部医学科)、豊田雅夫(東海大学医学部医学科)、北條裕信(大阪大学蛋白質研究所)、稲葉謙次(東北大学多元物質科学研究所)、岩岡道夫(東海大学理学部化学科) |
|
URL |
: |
|
|
DOI |
: |
10.1038/s42004-023-01056-4 |
用語解説
*1ポリペプチド鎖
構成単位であるアミノ酸がペプチド結合と呼ばれる結合で多数連なった生体高分子の総称。創薬モダリティのターゲットとしても注目されている。体内で、ある生理機能を果たしているポリペプチド鎖はタンパク質と呼ばれる。ゆえに、インスリンもタンパク質の一種。アミノ酸は主に20種類存在し、これらの連なる順番や数によってポリペプチド鎖の構造と機能が制御されている。
*2ジスルフィド結合
タンパク質の構造安定化因子の一つで、アミノ酸の一種であるシステインはチオール(SH)基という硫黄(S)を含む部位を持ち、2つのSH基が酸化することでジスルフィド結合が形成される。
*3セレノインスリン
インスリンのA鎖とB鎖の間で架橋される1対のジスルフィド結合の硫黄原子を安定性に富んだセレン(Se)原子に置き換えた人工インスリン。立体構造と生理活性が天然のインスリンと同じでありながら、インスリン分解酵素(IDE)に分解されにくい性質を持つため、体内で薬効が長時間持続する新たなインスリン製剤として糖尿病治療などへの応用が期待されている。
*4インスリン分解酵素(IDE)
腎臓や肝臓に主に分布する酵素で、健常者においては過剰分泌されたインスリンを分解する働きを持つ。
*5インスリン製剤
インスリンは、膵臓の中に島状に散在し内分泌機能を果たす細胞群であるランゲルハンス島から分泌される血糖抑制に関わるタンパク質である。糖尿病患者はインスリン分泌がうまくいかず、皮下注射によってインスリン製剤を投与する必要がある。インスリン製剤の化学合成では、①複数の保護基でシステインチオール基を保護し、段階的な脱保護と鎖間のジスルフィド架橋を行う化学的手法、②生合成機構を模倣し、A鎖とB鎖をリンカーペプチドで連結し、ジスルフィド結合を架橋後、リンカー部位を切除する方法――の主に2つの複雑な合成戦略が用いられてきた。
*6 Native Chain Assembly(NCA)
化学修飾などを持たない天然のインスリンA鎖とB鎖がジスルフィド結合の架橋を経て自己組織化(フォールディング)してインスリンの構造を構築すること。
*7多量体
化合物一分子(単量体)が複数結合した重合体のこと。単量体の数に応じて、二量体、三量体、四量体などと呼ぶ。
*8超遠心分析(AUC)
タンパク質溶液を高速で遠心し、遠心力場におかれたタンパク質分子が溶媒の中を沈降する様子をリアルタイムで観測・記録する。これにより、溶液に分散したタンパク質などの生体分子に関する多分散性、分子量、形状、解離/会合定数等を評価することができる。
*9円二色性(CD)分散計
試料に右回りおよび左回りの円偏光を照射し、その吸収の差を測定して有機化合物の立体構造を解析する装置。タンパク質などの生体分子の測定においては、分子のらせん構造(α-ヘリックスなど)やシート構造(β-シートなど)の含有量などを評価するとともに、熱や薬剤によるそれらの分子構造の安定性に関する情報を提供する。
|
<研究に関するお問い合わせ> 東海大学 理学部化学科 担当:荒井堅太、岩岡道夫 TEL.0463-58-1211(代表) 東北大学 学際科学フロンティア研究所 担当:奥村正樹 TEL.022-217-5628(直通) 大阪大学 蛋白質研究所 担当:北條裕信 TEL.06-6879-8601(直通)
<本件に関するお問い合わせ> 東海大学 学長室広報担当 担当:喜友名 浩史 TEL.0463-63-4670(直通) E-mail kiyuna@tsc.u-tokai.ac.jp 東北大学 学際科学フロンティア研究所 担当:藤原英明 E-mail hideaki@fris.tohoku.ac.jp 大阪大学 蛋白質研究所 研究戦略推進室 E-mail uraoffice@protein.osaka-u.ac.jp |