ここから本文です
女性由来多能性幹細胞(ES/iPS細胞)の試験管産物特有の異常を回避 女性細胞の恒常性維持に重要なX染色体不活化の再獲得化に成功 ~女性特有のがんや自己免疫疾患のメカニズム解明に光明~
2022年11月30日
東海大学[伊勢原校舎]医学部医学科基礎医学系の福田篤講師らの研究グループは、国立成育医療研究センター研究所 再生医療センターとの共同研究で、女性由来多能性幹細胞(ES細胞:胚性幹細胞/iPS細胞:人工多能性幹細胞)において不可逆的に失われたX染色体不活化の再獲得化に成功しました。また、X染色体不活化を再獲得化した患者由来のiPS細胞(疾患特異的iPS細胞1))では神経分化が確認され、正確な病態モデリング2)研究が可能であることも示しました。この研究成果は日本時間2022年11月30日(水)午前1時(米国東部時間2022年11月29日(火)午前11時)公開の生命科学誌『Cell Reports Methods』オンライン版に掲載されます。
■研究の背景
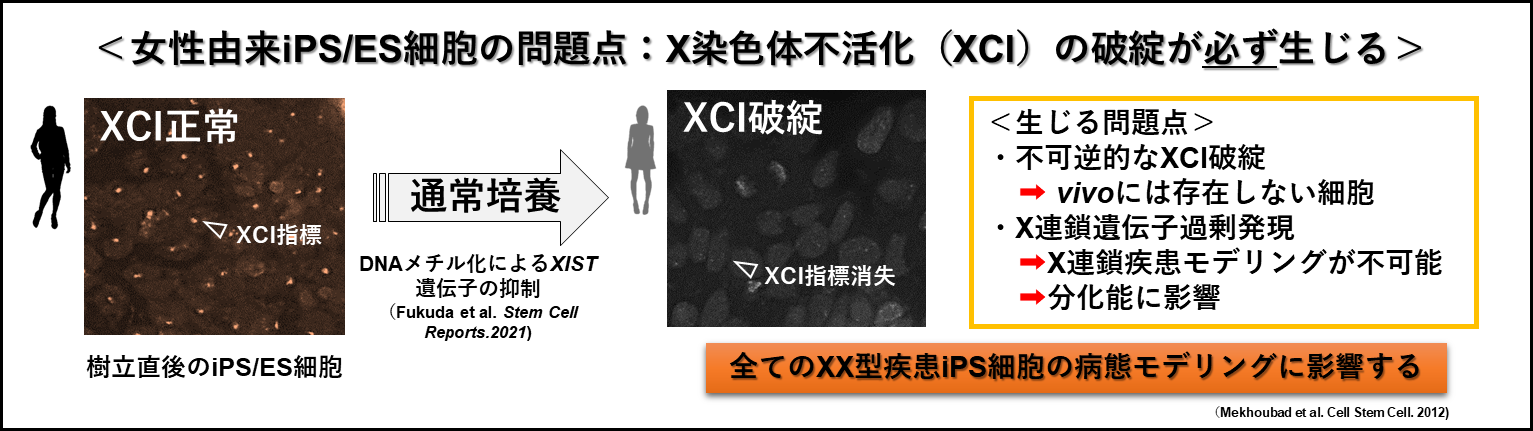
ヒト多能性幹細胞(ES/iPS細胞)は、体を構成するほぼすべての細胞へと分化できる万能細胞です。多能性幹細胞は、再生医学や薬剤応答試験など、ヒトの持つ遺伝的多様性を考慮した先端医療科学の中心的な存在でもあります。しかし、多能性幹細胞は体に実在しないことから、試験管産物特有の異常を示すことも報告されています。その代表的な例として、女性由来多能性幹細胞の特異的な性染色体であるX染色体の異常があり、“X染色体不活化の不可逆的破綻”と呼ばれています。
ヒトを含め、XX型(女性)の哺乳動物は、XY型(男性)と比べ、性染色体であるX染色体遺伝子の数が物理的に異なります。女性には2つのX染色体があるため、遺伝子数は2倍になりますが、体を構成するほとんどの女性細胞では、X染色体遺伝子が遺伝子数に比例して働かないようにする機能が元来備わっています。このメカニズムは“X染色体の不活化”と呼ばれ、男性の遺伝子量との補正の役割を担っています。X染色体の不活化を維持することは、女性細胞の恒常性の維持に極めて重要であり、近年では、女性特有のがんや自己免疫疾患との関連も報告されています。
一方、女性由来多能性幹細胞は、通常の培養条件ではX染色体の不活化が破綻し、多くのX染色体遺伝子が過剰に働きだします。その結果、生体内の細胞とは異なる状態となってしまい、その活用には大きな制限が懸念されてきました。特に、疾患特異的iPS細胞を用いた研究では、得られた実験結果が個人の遺伝的に有する遺伝子の変異に起因する異常なのか、試験管特有のX染色体不活化破綻により引き起こされたものなのか結論付けられないといった問題が指摘されてきました。そのため、多くの女性特有の病態モデリングは、男性の多能性幹細胞株を用いて行われており、女性の疾患iPS細胞の活用に大きな制限があるのが現実でした(下図参照)。
■研究成果の概要
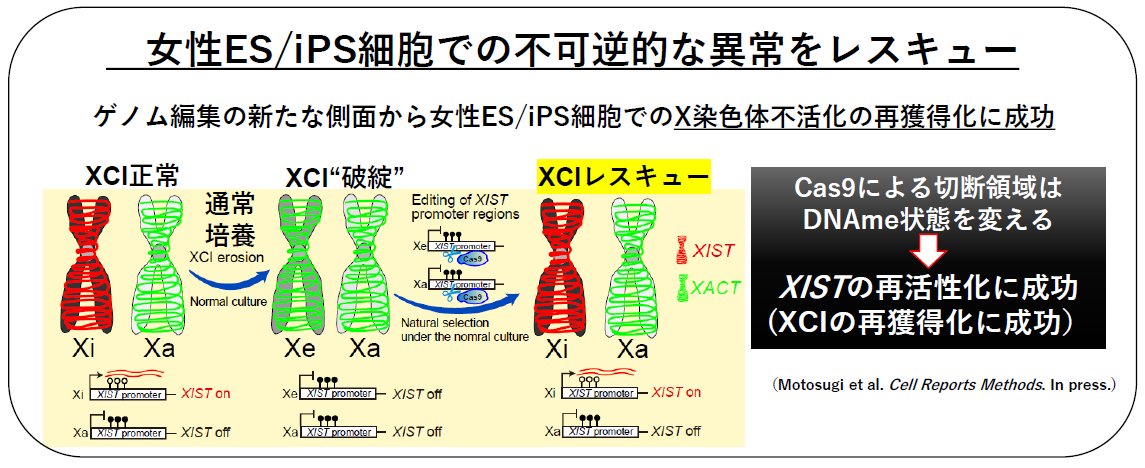
X染色体の不活化は、large non-coding RNA4)のXIST遺伝子5)によって制御されています。本研究グループではこれまでに、女性由来多能性幹細胞におけるXIST遺伝子の発現が不可逆的に抑制されることで、X染色体不活化の破綻が始まることを見出しました。特に、XIST遺伝子の発現を制御する領域(プロモーター領域6))において、DNAのメチル化7)が生じることで、XIST遺伝子の発現抑制が引き起こされることを明らかにしています。
今回の研究では、このXIST遺伝子のプロモーター領域のDNAメチル化状態を元に戻すことがXIST遺伝子の再活性化につながり、最終的にX染色体不活化を再獲得できるのではないかとの仮説を立てました。近年、Cas9ヌクレアーゼ8)によってDNAを切断するゲノム編集において、切断領域にDNAメチル化が蓄積することがあるとの報告があります。これに対し本研究グループは全く逆の現象を予測し、XIST遺伝子領域の異常なDNAメチル化がDNA切断により、脱メチル化される可能性を探りました。その結果、XIST遺伝子のプロモーター領域でDNA切断を引き起こさせると、DNAの脱メチル化が生じ、XIST遺伝子が再活性することがわかりました。具体的にはCas9ヌクレアーゼによるDNA切断を行うことで、切断領域のDNAメチル化状態が変化し、遺伝子の再活性化が可能であることを明らかにしました(下図参照)。さらに、XIST遺伝子が再活性化した女性由来多能性幹細胞では、最終的にX染色体不活化が復活することも明らかにしています。この現象は、検証したすべての女性由来ES/iPS細胞で確認され、再現性の高さが実証されました(特許出願済)。
また、X染色体不活化の再獲得化技術をレット症候群9)患者由来のiPS細胞(X染色体上のMECP2遺伝子10)が原因の神経発達異常などを示す)に応用しました。その結果、X染色体不活化が破綻したレットiPS細胞では神経発生が乏しいのに対し、X染色体不活化が復活した細胞では正常な神経分化が行われることを明らかにしました。これらの結果から、レット症候群由来iPS細胞の神経分化は、X染色体不活化状態を正常化させることで、本来の原因であるMECP2遺伝子による影響を解析することが初めて可能になり、X染色体不活化状態が正常な疾患iPS細胞を用いた病態モデリングの根幹技術の開発につながりました。
■本研究の意義と今後の展望
ヒトは多様性に富んだ生き物であり、疾患の発症や薬効などでも「性差」は大きな要因となっています。iPS細胞技術、ゲノム編集技術は生命医学研究において強力なツールであることは確かですが、試験管培養における女性由来多能性幹細胞特有のX染色体不活化破綻の影響は、生体内での現象とは異なる結果をもたらすことが今回の研究で実証されました。本研究成果が女性由来多能性幹細胞の活用の幅を飛躍的に広げるとともに、女性特有の疾患メカニズムの解明につながることが期待されます。
■特記事項
本研究は以下の支援をもとに行われました。
国立研究開発法人日本医療研究開発機構(AMED)
・再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)代表:福田篤「ヒト多能性幹細胞を用いた転写/エピゲノム多様性・性差に基づく神経細胞分化能の制御機構解明と予測モデルの構築」(19bm0704038h0001)
・再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム)代表:福田篤「革新的遺伝子量補正法による性特異的X連鎖難治疾患iPS細胞を用いた脳神経病態モデリングに関する研究開発」(21bm0804030h0001)
■掲載論文
掲載誌 : Cell Reports Methods. (オンライン版)
タイトル : De-erosion of X-chromosome dosage compensation by editing of XIST regulatory regions restores differentiation potential in hPSCs.
掲載日 日本時間2022年11月30日(水)午前1時〔米国東部時間2022年11月29日(火)午前11時〕
著者 : 本杉奈美1、杉山晶子1、岡田千沙4、大友麻子1,2,3、梅澤明弘5、阿久津英憲5、秦野伸二1,2,3、福田篤1,2,3,5 (#)(#Corresponding Author)
所属情報
1.東海大学医学部医学科基礎医学系分子生命科学
2.東海大学総合医学研究所
3.東海大学マイクロナノテクノロジーセンター
4.東海大学生命科学統合支援センター
5.国立成育医療研究センター研究所 再生医療センター
DOI : doi.org/10.1016/j.crmeth.2022.100352
■用語解説
1)疾患特異的iPS細胞:遺伝性変異などをもつ患者から樹立されたiPS細胞。疾患の病態を試験管で、遺伝的背景を考慮し、解析可能である。患者特有の病態モデリングや薬剤応答解析などに役立つ。
2)病態モデリング:ES/iPS細胞を用いて、培養容器の中で病気を再現させる医学研究。疾患発症のメカニズム解明や効果的な薬剤選抜に大いに役立つ。
3)試験管産物:培養容器の中で作製された細胞や現象。本来、生体には存在しない細胞や現象を示す。
4)large non-coding RNA:RNAの一種であり、タンパク質を作らない遺伝子(“非コードRNA”とも呼ぶ)。RNA分子の中でも大きな分子を示す。具体的な定義はないが、数Kb~数百Kbまであるものもある。タンパク質を作らないが、RNA分子としてDNAや他のRNAに作用することで、遺伝子発現を制御することがある。
5)XIST遺伝子:Large non-coding RNAの代表的な遺伝子。X染色体に存在し、X染色体不活化の開始、維持に必須であり、女性細胞においてのみ確認される。XIST RNA分子は、発現した染色体全体の機能を抑制することが出来る。ヒトを含む哺乳動物では、1つの遺伝子で染色体全体を制御する遺伝子は、XIST以外報告がない。
6)プロモーター領域:遺伝子の発現(働き)を制御するDNA領域。遺伝子本体やその上流に位置することが多く、DNAメチル化修飾を介して、遺伝子の発現制御が行われることが多い。
7)DNAメチル化:DNAにメチル基が修飾されることで、タンパク質の結合などが変化し、遺伝子発現に影響を及ぼすエピジェネティックな機構の一種。
8)Cas9ヌクレアーゼ:Cas9と呼ばれるタンパク質であり、DNAを切断する機能をもつ。ゲノム編集における“はさみ”のような役割を担っており、DNAを切断する。通常のゲノム編集では、DNA切断後に、細胞が持つ“自己修復機能”によって、切断DNAは修復される。今回の研究では、Cas9ヌクレアーゼによるDNAの修復後に、DNAメチル化状態までは、完全に回復出来ないことを発見した。この“不完全な修復”を利用し、XIST遺伝子の再獲得化(DNAの脱メチル化XIST遺伝子の活性化)に成功した。
9)レット症候群:女児特異的に発症する神経疾患であり、難病指定されている。精神発達遅滞やてんかんなど様々な神経症状が生じるが、根本的な治療法が確立されていない
10)MECP2遺伝子:X染色体上に存在するDNA結合性タンパク質で多くの遺伝子の発現を制御する。多くのレット症候群患者では、MECP2遺伝子のヘテロ変異(2対ある遺伝子のうち、1つが変異を持つ状態)が確認される。男性の場合は、X染色体が1つしかないため、MECP2に変異を持つ場合、生体まで至らず胚性で致死となると考えられている。
<研究に関するお問い合わせ>
東海大学医学部医学部医学科基礎医学系 福田篤
TEL. 0463-93-1121(代表)Email:fa972942@tsc.u-tokai.ac.jp
東海大学 ビーワンオフィス 担当:喜友名、林
TEL.0463-63-4670(直通) E-mail:pr@tsc.u-tokai.ac.jp
■研究の背景
ヒト多能性幹細胞(ES/iPS細胞)は、体を構成するほぼすべての細胞へと分化できる万能細胞です。多能性幹細胞は、再生医学や薬剤応答試験など、ヒトの持つ遺伝的多様性を考慮した先端医療科学の中心的な存在でもあります。しかし、多能性幹細胞は体に実在しないことから、試験管産物特有の異常を示すことも報告されています。その代表的な例として、女性由来多能性幹細胞の特異的な性染色体であるX染色体の異常があり、“X染色体不活化の不可逆的破綻”と呼ばれています。
ヒトを含め、XX型(女性)の哺乳動物は、XY型(男性)と比べ、性染色体であるX染色体遺伝子の数が物理的に異なります。女性には2つのX染色体があるため、遺伝子数は2倍になりますが、体を構成するほとんどの女性細胞では、X染色体遺伝子が遺伝子数に比例して働かないようにする機能が元来備わっています。このメカニズムは“X染色体の不活化”と呼ばれ、男性の遺伝子量との補正の役割を担っています。X染色体の不活化を維持することは、女性細胞の恒常性の維持に極めて重要であり、近年では、女性特有のがんや自己免疫疾患との関連も報告されています。
一方、女性由来多能性幹細胞は、通常の培養条件ではX染色体の不活化が破綻し、多くのX染色体遺伝子が過剰に働きだします。その結果、生体内の細胞とは異なる状態となってしまい、その活用には大きな制限が懸念されてきました。特に、疾患特異的iPS細胞を用いた研究では、得られた実験結果が個人の遺伝的に有する遺伝子の変異に起因する異常なのか、試験管特有のX染色体不活化破綻により引き起こされたものなのか結論付けられないといった問題が指摘されてきました。そのため、多くの女性特有の病態モデリングは、男性の多能性幹細胞株を用いて行われており、女性の疾患iPS細胞の活用に大きな制限があるのが現実でした(下図参照)。
■研究成果の概要
X染色体の不活化は、large non-coding RNA4)のXIST遺伝子5)によって制御されています。本研究グループではこれまでに、女性由来多能性幹細胞におけるXIST遺伝子の発現が不可逆的に抑制されることで、X染色体不活化の破綻が始まることを見出しました。特に、XIST遺伝子の発現を制御する領域(プロモーター領域6))において、DNAのメチル化7)が生じることで、XIST遺伝子の発現抑制が引き起こされることを明らかにしています。
今回の研究では、このXIST遺伝子のプロモーター領域のDNAメチル化状態を元に戻すことがXIST遺伝子の再活性化につながり、最終的にX染色体不活化を再獲得できるのではないかとの仮説を立てました。近年、Cas9ヌクレアーゼ8)によってDNAを切断するゲノム編集において、切断領域にDNAメチル化が蓄積することがあるとの報告があります。これに対し本研究グループは全く逆の現象を予測し、XIST遺伝子領域の異常なDNAメチル化がDNA切断により、脱メチル化される可能性を探りました。その結果、XIST遺伝子のプロモーター領域でDNA切断を引き起こさせると、DNAの脱メチル化が生じ、XIST遺伝子が再活性することがわかりました。具体的にはCas9ヌクレアーゼによるDNA切断を行うことで、切断領域のDNAメチル化状態が変化し、遺伝子の再活性化が可能であることを明らかにしました(下図参照)。さらに、XIST遺伝子が再活性化した女性由来多能性幹細胞では、最終的にX染色体不活化が復活することも明らかにしています。この現象は、検証したすべての女性由来ES/iPS細胞で確認され、再現性の高さが実証されました(特許出願済)。
また、X染色体不活化の再獲得化技術をレット症候群9)患者由来のiPS細胞(X染色体上のMECP2遺伝子10)が原因の神経発達異常などを示す)に応用しました。その結果、X染色体不活化が破綻したレットiPS細胞では神経発生が乏しいのに対し、X染色体不活化が復活した細胞では正常な神経分化が行われることを明らかにしました。これらの結果から、レット症候群由来iPS細胞の神経分化は、X染色体不活化状態を正常化させることで、本来の原因であるMECP2遺伝子による影響を解析することが初めて可能になり、X染色体不活化状態が正常な疾患iPS細胞を用いた病態モデリングの根幹技術の開発につながりました。
■本研究の意義と今後の展望
ヒトは多様性に富んだ生き物であり、疾患の発症や薬効などでも「性差」は大きな要因となっています。iPS細胞技術、ゲノム編集技術は生命医学研究において強力なツールであることは確かですが、試験管培養における女性由来多能性幹細胞特有のX染色体不活化破綻の影響は、生体内での現象とは異なる結果をもたらすことが今回の研究で実証されました。本研究成果が女性由来多能性幹細胞の活用の幅を飛躍的に広げるとともに、女性特有の疾患メカニズムの解明につながることが期待されます。
■特記事項
本研究は以下の支援をもとに行われました。
国立研究開発法人日本医療研究開発機構(AMED)
・再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)代表:福田篤「ヒト多能性幹細胞を用いた転写/エピゲノム多様性・性差に基づく神経細胞分化能の制御機構解明と予測モデルの構築」(19bm0704038h0001)
・再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム)代表:福田篤「革新的遺伝子量補正法による性特異的X連鎖難治疾患iPS細胞を用いた脳神経病態モデリングに関する研究開発」(21bm0804030h0001)
■掲載論文
掲載誌 : Cell Reports Methods. (オンライン版)
タイトル : De-erosion of X-chromosome dosage compensation by editing of XIST regulatory regions restores differentiation potential in hPSCs.
掲載日 日本時間2022年11月30日(水)午前1時〔米国東部時間2022年11月29日(火)午前11時〕
著者 : 本杉奈美1、杉山晶子1、岡田千沙4、大友麻子1,2,3、梅澤明弘5、阿久津英憲5、秦野伸二1,2,3、福田篤1,2,3,5 (#)(#Corresponding Author)
所属情報
1.東海大学医学部医学科基礎医学系分子生命科学
2.東海大学総合医学研究所
3.東海大学マイクロナノテクノロジーセンター
4.東海大学生命科学統合支援センター
5.国立成育医療研究センター研究所 再生医療センター
DOI : doi.org/10.1016/j.crmeth.2022.100352
■用語解説
1)疾患特異的iPS細胞:遺伝性変異などをもつ患者から樹立されたiPS細胞。疾患の病態を試験管で、遺伝的背景を考慮し、解析可能である。患者特有の病態モデリングや薬剤応答解析などに役立つ。
2)病態モデリング:ES/iPS細胞を用いて、培養容器の中で病気を再現させる医学研究。疾患発症のメカニズム解明や効果的な薬剤選抜に大いに役立つ。
3)試験管産物:培養容器の中で作製された細胞や現象。本来、生体には存在しない細胞や現象を示す。
4)large non-coding RNA:RNAの一種であり、タンパク質を作らない遺伝子(“非コードRNA”とも呼ぶ)。RNA分子の中でも大きな分子を示す。具体的な定義はないが、数Kb~数百Kbまであるものもある。タンパク質を作らないが、RNA分子としてDNAや他のRNAに作用することで、遺伝子発現を制御することがある。
5)XIST遺伝子:Large non-coding RNAの代表的な遺伝子。X染色体に存在し、X染色体不活化の開始、維持に必須であり、女性細胞においてのみ確認される。XIST RNA分子は、発現した染色体全体の機能を抑制することが出来る。ヒトを含む哺乳動物では、1つの遺伝子で染色体全体を制御する遺伝子は、XIST以外報告がない。
6)プロモーター領域:遺伝子の発現(働き)を制御するDNA領域。遺伝子本体やその上流に位置することが多く、DNAメチル化修飾を介して、遺伝子の発現制御が行われることが多い。
7)DNAメチル化:DNAにメチル基が修飾されることで、タンパク質の結合などが変化し、遺伝子発現に影響を及ぼすエピジェネティックな機構の一種。
8)Cas9ヌクレアーゼ:Cas9と呼ばれるタンパク質であり、DNAを切断する機能をもつ。ゲノム編集における“はさみ”のような役割を担っており、DNAを切断する。通常のゲノム編集では、DNA切断後に、細胞が持つ“自己修復機能”によって、切断DNAは修復される。今回の研究では、Cas9ヌクレアーゼによるDNAの修復後に、DNAメチル化状態までは、完全に回復出来ないことを発見した。この“不完全な修復”を利用し、XIST遺伝子の再獲得化(DNAの脱メチル化XIST遺伝子の活性化)に成功した。
9)レット症候群:女児特異的に発症する神経疾患であり、難病指定されている。精神発達遅滞やてんかんなど様々な神経症状が生じるが、根本的な治療法が確立されていない
10)MECP2遺伝子:X染色体上に存在するDNA結合性タンパク質で多くの遺伝子の発現を制御する。多くのレット症候群患者では、MECP2遺伝子のヘテロ変異(2対ある遺伝子のうち、1つが変異を持つ状態)が確認される。男性の場合は、X染色体が1つしかないため、MECP2に変異を持つ場合、生体まで至らず胚性で致死となると考えられている。
<研究に関するお問い合わせ>
東海大学医学部医学部医学科基礎医学系 福田篤
TEL. 0463-93-1121(代表)Email:fa972942@tsc.u-tokai.ac.jp
東海大学 ビーワンオフィス 担当:喜友名、林
TEL.0463-63-4670(直通) E-mail:pr@tsc.u-tokai.ac.jp