ここから本文です
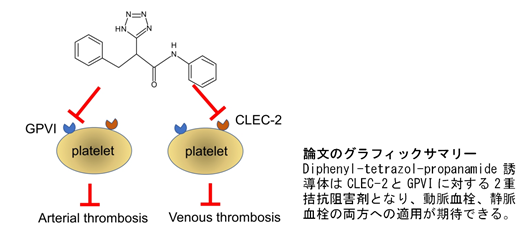
血小板のポドプラニン受容体(CLEC-2)とコラーゲン受容体(GPVI)の両方を 選択的に阻害できる化合物基本構造を世界で初めて発見 ~癌関連血栓症や動脈硬化関連血栓症などに有効な薬剤の開発に道~
2023年12月20日
東海大学[伊勢原キャンパス]医学部総合診療学系救命救急医学の渡邊伸央講師、猪口貞樹客員教授らの研究グループは、約700万の既存化合物から、ヒトならびにマウスの血小板のポドプラニン*1受容体(CLEC-2)*2とコラーゲン受容体(GPVI)*3の両方を選択的に阻害できる化合物基本構造を世界で初めて発見しました。本研究成果は11月15日(水)、学術誌「Thrombosis and Haemostasis」(オンライン版)に掲載されました。
|
ポイント Ø 抗血小板薬関連の研究者の間では困難とされていた血小板のポドプラニン受容体(CLEC-2)とコラーゲン受容体(GPVI)に対する低分子阻害剤の開発に道筋をつけた。 Ø 癌関連血栓症、癌転移、動脈硬化関連血栓症などに有効な薬剤の開発が加速されることに期待。 |
 |
■研究の背景
血小板は血管損傷部位で活性化され、凝集することで損傷部を塞ぎ、止血を担う重要な因子です。しかし、癌や動脈硬化などの病的な状態での血小板凝集は、血管を塞ぎ血栓症を引き起こします。血小板表面には、コラーゲン受容体を含め、血小板凝集反応を引き起こす受容体が10数種類存在しますが、アスピリンやクロピドグレルなど、今日用いられている抗血小板薬は、各受容体の活性化の結果、下流で共通して起こる2次反応を抑制するものであるため、血栓症のリスクを有する患者に対して広く予防的に適用できる半面、選択性がないため出血のリスクを伴うという問題点があります。このため、各受容体に対して選択的な抗血小板薬(特に経口投与可能な低分子化合物)の開発が望まれています。
■研究の概要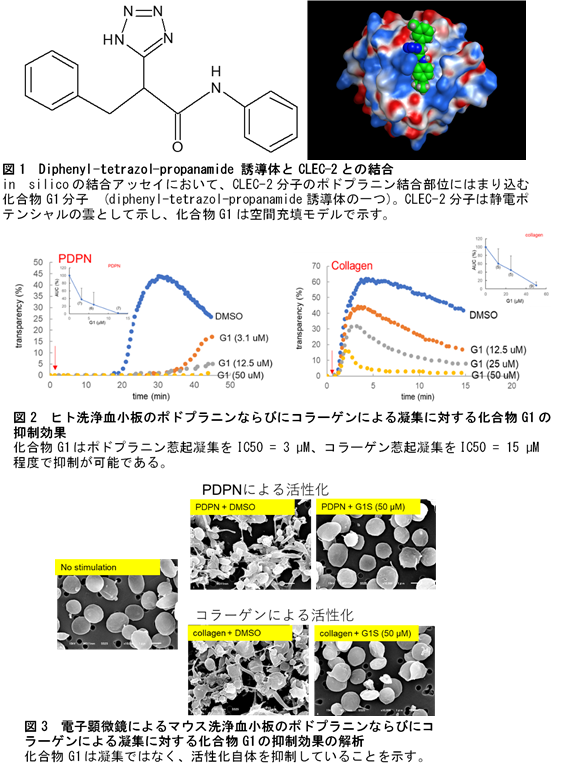
血小板上にある受容体のうちCLEC-2は、ポドプラニンによって、また、GPVI はコラーゲンによって活性化されます。本研究グループは、癌関連血栓症、癌転移、動脈硬化関連血栓症への適用を目指し、血小板受容体CLEC-2に対する阻害化合物の開発を行いました。独自のコンピュータプログラムによる
化合物結合評価(in silico結合評価)*4によって、約700万の既存の化合物から抗CLEC-2候補化合物を絞り込み、このうちの約100化合物を入手して実験的検証を行いました。この結果、diphenyl-tetrazol-propanamide骨格*5を有
する12化合物がCLEC-2のポドプラニン結合部位、さらにGPVIのコラーゲン結合部位の両方にフィットし、実際にポドプラニンならびにコラーゲンそれぞれとの相互作用を阻害することにより、ヒトならびにマウスの血小板の凝集反応を抑制することを見
い出しました。ただし、マウス血栓症モデルにおいては薬効が減弱してしまうこが判明しました。この現象に対し、原因が血中アルブミンとの結合が強すぎるためであることを解明し、今後実用化に必要な基本骨格への構造改変の方向性を示しました。本研究により、これまで阻害剤開発は困難とされていたCLEC-2、GPVI両受容体への低分子阻害剤開発に道が開かれました。
■研究の経緯
平成24(2012)年度から東海大学で行われた文科省「私立大学戦略的研究基盤形成支援事業(がん幹細胞ニッチを標的とした新規治療法の開発)」に参加していた猪口教授は、癌幹細胞の表面マーカーとされる様々なタンパク質の機能を調べていました。これらの中で、正常リンパ管上皮等に見られるタンパク質ポドプラニンを表面に持つヒト扁平上皮癌由来細胞株は、移動性や浸潤性が高く、また免疫不全マウスに移植後の増殖が速いことを発見しました。さらに消化器外科学、病理学と共同で、本学付属病院で食道癌切除手術を受けた患者140名の切除癌組織の病理標本を用いて免疫染色を行ったところ、癌先進部(癌の浸潤していく先端部)におけるポドプラニンの発現量が、他の因子とは独立に食道癌患者の生命予後と強く相関することが明らかになりました(文献①)。当時、ポドプラニンは癌の悪性度との関連が報告されていましたが、血小板膜上のCLEC-2という受容体に結合して血小板を活性化させる作用がある以外、その機能は解明されていませんでした。猪口教授は、この相関の発見の段階でポドプラニンとCLEC-2の結合を阻害できる化合物は食道癌などの悪化・再発を防げると確信し、2016年度から本学先進先端科学研究所の研究ユニットに参画。不退転の決意で創薬をゴールとする挑戦的な研究プロジェクトに着手しました。
文献①:Expression of podoplanin and vimentin is correlated with prognosis in esophageal squamous cell carcinoma.
Tanaka M, Kijima H, Shimada H, Makuuchi H, Ozawa S, Inokuchi S.
Mol Med Rep. 2015 Sep;12(3):4029-4036. doi: 10.3892/mmr.2015.3966.
この研究プロジェクトでまず行ったのは、in silicoでの創薬の第一人者で先進先端科学研究所の平山令明教授(当時)と共同での分子標的の絞り込みでした。平山教授は、当時理化学研究所の研究グループから発表されたばかりのCLEC-2とポドプラニンとのX線結晶解析のデータを用い、CLEC-2分子のポドプラニンとの結合様式の詳細を解析しました。そして、CLEC-2分子のポドプラニン結合部位に強固にはまり込む化合物を、既存の化合物ライブラリー84万化合物からスクリーニングを行いました。一方、救命救急科研究員の渡邊伸央と本学工学部生命科学科の卒業研究生(当時)の鈴木雄祐は、CLEC-2とポドプラニンの遺伝子をクローニングして遺伝子組み換えタンパク質を作製し、CLEC-2-ポドプラニン結合に対する化合物の阻害能を測定できるプルダウン評価系を構築しました。in silicoスクリーニングで上位にランクされた20化合物を入手し、このプルダウン評価系で阻害活性を検証した結果、1化合物(B9)がヒット化合物として得られました。そこで、B9とCLEC-2との結合様式をさらにin silicoで解析し、この情報を加えて既存の700万化合物から再スクリーニングを行いました。こうして上位にランクされた15化合物を入手し、実験的に検証した結果、diphenyl-tetrazol-propanamide骨格を有する2化合物(D12、D13)が阻害能を示しました。そこでdiphenyl-tetrazol-propanamide骨格を有する化合物に焦点を当て、入手可能な36化合物を評価した結果、最終的に先の2化合物に加えた計12化合物(Gシリーズ化合物)に阻害活性があることを突き止めました。
次にヒトならびにマウスの洗浄血小板を用いてポドプラニン惹起血小板凝集に対する化合物の阻害活性を評価しました。12化合物のいずれもポドプラニン惹起に対しては阻害を示しましたが、トロンビンやADPなど、他の刺激剤による凝集に対してはほとんど影響しないことが確認されました。ところが予想外にも、コラーゲン惹起による凝集に対してはいずれも抑制することがわかりました。そこでdiphenyl-tetrazol-propanamide骨格とコラーゲン受容体GPVIとの結合をin silicoで解析した結果、diphenyl-tetrazol-propanamideはGPVI分子のコラーゲン結合部位にも強力にはまり込むことが明らかになりました。さらに遺伝子組み換えGPVIタンパク質とコラーゲンとの結合に対しても化合物が阻害することも実験的に確認し、化合物のコラーゲン惹起血小板凝集に対する抑制効果が特異的なものであることを確認しました。
次に動物モデルでの薬効評価を行いました。本学の生命科学統合支援センター動物部門の篠崎よし子らを中心に、ポドプラニンの寄与が大きいとされる深部静脈血栓モデル、ならびにコラーゲン誘導肺塞栓モデルを作製し、抗血栓作用を評価しました。しかし、いずれのモデルにおいても化合物投与により血栓抑制傾向は見られたものの統計的に有意な差は確認されませんでした。ただし、コラーゲン誘導肺塞栓モデルにおいては血中の血小板低下を抑制していることがわかりました。この原因を探った結果、生体内では血中アルブミンとの結合により、化合物がCLEC-2やGPVIの標的部位に結合できなくなり、抗血小板能を低下させていることがわかりました。今後はdiphenyl-tetrazol-propanamide骨格に化学修飾を施し、アルブミン結合を低下させる必要があります。
CLEC-2-ポドプラニン結合、GPVI-コラーゲン結合はいずれも、タンパク質-タンパク質相互作用であり複数の結合部位が関与するため、現在、抗血小板薬関連の研究者の間では、低分子阻害剤開発は難易度が高いとされています。本研究グループが創薬を目指した研究構想から10余年を経て今回、約700万の化合物からCLEC-2とGPVIの両方のリガンド結合部位を塞ぐ、化合物基本構造の取得に世界で初めて成功するとともに、今後の実用化に道筋をつける提案をしました。
■今後期待されること
癌患者における静脈血栓症は死因の約2割を占めており、この一部はポドプラニンによる血小板CLEC-2の活性化を介した凝集による静脈血栓が関与しているとされています。一方、動脈硬化症では、動脈硬化プラークが崩壊し、基底膜のコラーゲンによって血小板のGPVIとの結合を介した凝集が誘導され、心筋梗塞や脳梗塞の原因となる動脈血栓が発生します。現在、CLEC-2ならびにGPVIに対する低分子阻害剤は、臨床現場のみならず臨床試験を含めて存在しません。今回、本研究グループが見い出したdiphenyl-tetrazol-propanamide基本骨格に改変を加え最適化を施すことによって、癌関連血栓症、癌転移ならびに動脈硬化関連血栓症に有効な治療薬・予防薬の開発が加速されることが期待されます。
■論文情報
|
タイトル |
: |
Diphenyl-tetrazol-propanamide derivatives act as dual-specific antagonists of platelet CLEC-2 and GPVI. |
|
論文誌 |
: |
Thrombosis and Haemostasis |
|
掲載日 |
: |
2023年11月15日(水) |
|
著者 |
: |
〔責任著者〕 渡邊伸央(東海大学医学部総合診療学系救命救急医学 講師) 猪口貞樹(東海大学医学部 客員教授) 〔発表者〕 渡邊伸央*1、篠崎よし子*2、荻原早苗*2、宮ヶ迫理子*2、鈴木雄祐*2、加藤順子*2、福西菜津子*2、岡田義則*2、斉藤剛*1、飯田祐美*2、東瀬戸美咲*2、増田治史*3、後藤和人*4、網野真理*1、辻友篤*1、守田誠司*1、永田栄一郎*5、平山令明*6、猪口貞樹*7
*1東海大学医学部総合診療学系救命救急医学 *2東海大学生命科学統合支援センター *3東海大学基礎医学系生理学/湘南先端医学研究所 *4東海大学臨床検査医学 *5東海大学内科学系神経内科学 *6東海大学総合医学研究所 *7東海大学医学部医学科 |
|
DOI |
: |
10.1055/a-2211-5202 |
■研究助成
1)「CLEC2とpodoplaninの結合を阻害する低分子化合物の探索」
東海大学先進生命科学研究所助成金 課題番号M2016
2)「ポドプラニンに依存したガンの転移や血栓症を制御する新規化合物」
国立研究開発法人日本医療研究開発機構(AMED)橋渡し研究シーズA、課題番号A365TS
3)「CLEC-2とGPVIを標的とした新規抗血小板薬の開発とその適応症の探索」科研費基盤研究(C) 課題番号23K07490
〔用語解説〕
*1 ポドプラニン
幾つかの癌細胞の細胞膜に発現する糖タンパク質。血小板CLEC-2と結合して血小板活性化を引き起こすため、血管壁をはじめ血液と接する組織には通常発現していない。現在ポドプラニンの発現量は食道癌以外の癌でも予後不良に関与することが示されている。
*2 ポドプラニン受容体(CLEC-2)
C-type lectin-like receptor 2、血小板膜上の糖タンパク質。癌細胞のポドプラニンの結合によって活性化した血小板は、細胞内顆粒に蓄えられてる種々の生理活性分子を放出する。これらは癌細胞に作用し、癌細胞の組織浸潤能、転移能を亢進させる。
*3 コラーゲン受容体(GPVI)
Glycoprotein VI、血小板膜上には間接的な受容体を含め3種のコラーゲン受容体があり、コラーゲンと直接結合する受容体の一つ。脳卒中や心筋梗塞では、動脈硬化症のプラークが崩壊した際に、露出したコラーゲンによってGPVIを介した血小板凝集が起こり、血栓ができ血管が詰まる。
*4 化合物結合評価(in silico結合評価)
コンピュータ上において、受容体タンパク質のリガンド結合部位(鍵穴に相当)に対して、既存の化合物(化合物ライブラリー)を一つ一つ当てはめ、はまり込む化合物(鍵に相当)を見つけること。
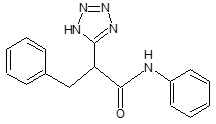
*5 diphenyl-tetrazol-propanamide骨格
下記の化学構造となります。
 |
|
<研究に関するお問い合わせ> 東海大学 医学部総合診療学系救命救急医学 渡邊伸央講師 TEL.0463-93-1121(代表)E-mail wn600365@tsc.u-tokai.ac.jp
<本件に関するお問い合わせ> 東海大学 学長室広報担当 担当:喜友名 浩史 TEL.0463-63-4670(直通)E-mail kiyuna@tsc.u-tokai.ac.jp |

