ここから本文です
個別のヒト免疫反応を再現する「免疫ヒト化マウス」で IgG抗体の誘導に成功 ~ヒトIL-4発現マウスを用い、抗体医薬・ワクチン開発の新たな実験基盤を確立~
2025年12月25日
東海大学[伊勢原キャンパス]医学部の亀谷美恵客員准教授らの研究グループは、ヒトの免疫反応を再現する次世代型「免疫ヒト化マウス」の開発に成功しました。本研究成果は2025年11月26日付で学術誌「Frontiers in Immunology」に掲載されました。
感染症やがん治療薬の研究に免疫学的手法は今や不可欠な存在です。一方、免疫系は人により大きく異なり、個人の効果予測が難しいという問題があります。ヒトの免疫反応を体内で再現できる「免疫ヒト化マウス」は、その問題を解決するために不可欠ですが、従来のマウスモデルでは、ヒト免疫の主役のひとつである「IgG抗体*1」の産生を個別の患者で評価することができず、長年の課題でした。同研究グループは今回、ヒトの免疫を動かす物質「インターロイキン4(IL-4)*2」を体内で作り続ける特殊なマウスを用いることで、この課題を解決しました。本研究により開発されたマウスは、ヒトのB細胞*3を長期間維持し、高機能なヒトIgG抗体を産生することに成功しました。さらに、マウスの体内(脾臓)には、ヒトのリンパ組織に似た構造が形成されていることも確認しました。これは、ヒトの免疫反応(液性免疫)をより正確に再現できる新たな実験モデルの誕生を意味します。この成果により、これまで困難だった動物実験段階での精密なワクチン評価が可能となり、抗体医薬開発のスピードアップに大きく貢献することが期待されます。
<ポイント>
| ● |
IL-4がマウス体内でヒトB細胞の生存とクラススイッチ*4(IgM→IgG)を強力に促進することを明らかにした。 |
| ● |
ヒト化免疫マウス体内で、血漿中ヒトIL-4濃度が100~1,000pg/mLの範囲で、ヒトB細胞の生着とIgGヘのクラススイッチが促進されることを示した。 |
| ● |
脾臓にヒトB細胞とT細胞からなる三次リンパ組織様構造(TLS)*5が形成され、限定的な親和性成熟に関わる免疫応答の場となっている可能性が示された。 |
| ● |
標的ペプチドに反応するIgGを分泌するヒトB細胞ハイブリドーマの作製に成功。 |
| ● |
ヒト免疫反応をin vivoで評価できる研究基盤として、抗体医薬やワクチン研究への応用に期待。 |
■研究の背景
免疫チェックポイント阻害薬やがんワクチンなど、ヒトの免疫反応を利用した治療法が拡大する中、個別ヒト抗体応答をより正確に再現できる前臨床モデルの必要性が高まっています。しかし、従来の免疫不全マウスではヒトB細胞の生存が短く、抗原特異的IgG産生誘導の評価が困難でした。本研究グループは、ヒトIL-4を恒常的に発現するNOG-hIL-4トランスジェニックマウス*6にヒト末梢血単核球(PBMC)*7を移植し、個別のヒト免疫系の再構築を試みました。IL-4はヒトB細胞の活性化や生存に重要なサイトカインであるものの、ヒト化マウスモデルにおける具体的な作用については十分に明らかになっていませんでした。
■研究成果
PBMCを移植した今までのヒト化マウスは、末梢血中の免疫細胞を用いているため、マウス体内で急速にヒトT細胞のみが活性化して増殖しマウスを攻撃すること(Graft-versus-Host Disease; GVHD)により、マウスが死亡することが知られていました。しかし本ヒト化マウスでは、100pg/mlから1000pg/mlという非常に限られた血漿中のIL-4濃度によりヒトB細胞の生存や増殖が可能となり、GVHDが大幅に遅延することが明らかになりました。移植後約4週間経過した時点では、上記の範囲の血漿中ヒトIL-4濃度では、脾臓においてヒトB細胞が高い生着率を示しました(図1)。さらに、移植後にIgGを産生するB細胞クローンが増加し、移植直後の時期にはIgG3が優勢で、その後時間とともにIgG3は減少し、一部のドナーではIgG1が増加するなど、IgGサブクラス構成が時間経過によりヒトと同様の変化をすることが分かりました。
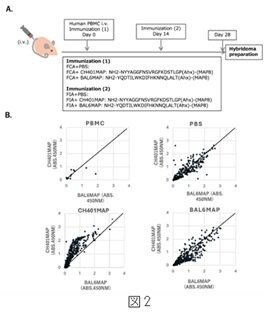 加えて、IgGクローンの可変領域には多数のアミノ酸置換が認められ、体細胞超変異(SHM)*8が生じていることが確認されました。これは、親和性成熟に至る初期過程が生じていることを示唆する所見です。また、HER2*9由来ペプチドであるCH401MAP*10やBAL6MAP*11で免疫した個体からは、これらのペプチドに反応する複数のヒトIgGクローンが得られ、IgGを分泌するヒトB細胞ハイブリドーマの作製にも成功しました(図2)。
加えて、IgGクローンの可変領域には多数のアミノ酸置換が認められ、体細胞超変異(SHM)*8が生じていることが確認されました。これは、親和性成熟に至る初期過程が生じていることを示唆する所見です。また、HER2*9由来ペプチドであるCH401MAP*10やBAL6MAP*11で免疫した個体からは、これらのペプチドに反応する複数のヒトIgGクローンが得られ、IgGを分泌するヒトB細胞ハイブリドーマの作製にも成功しました(図2)。
さらに、脾臓においてはヒトB細胞の集族とT細胞層が明瞭に形成された三次リンパ組織様構造(TLS様構造)が観察されました。これらのTLS様構造は、完全な胚中心は認められないものの、免疫応答や限定的な免疫成熟を支える微小環境が体内で形成されている可能性を示すものであり、本ヒト化免疫マウスが健常者や患者など各ドナーの持つB細胞がどのような抗体を産生しうるのかなどのヒト免疫応答の再現に有用であることを裏付ける結果となりました。
■社会的インパクト
今回の研究で得られた成果は、ヒト免疫応答を再現する前臨床モデルの高度化に貢献するだけでなく、抗体医薬候補の評価やがんワクチン開発、さらには個別化医療の実現に向けた免疫応答解析など、幅広い分野での応用が期待されます。
特に、ヒトB細胞の生着やヒトIgG産生には血漿中ヒトIL-4濃度が一定の範囲にあることが重要であることを示した点は、将来的にヒト抗体産生を調節するための新たなアプローチや標的探索につながる可能性を示すものであり、免疫医療の発展に重要な示唆を与えるものです。
■今後の展開
今後はヒトB細胞の長期的な生存を可能にする環境因子の解明を進めるとともに、胚中心(GC)のより完全な形成を目指したモデル改良を図っていきます。併せて、抗体医薬やワクチン開発への応用研究や、特異性の高いヒト抗体産生ハイブリドーマをより効率よく作製するための手法開発にも取り組む予定です。これらの取り組みにより、ヒト免疫をより精密に再現する研究モデルとしての発展が期待され、免疫医療のさらなる前進に寄与するものと考えられます。
■論文情報
| ◇ | 掲載誌 | : | Frontiers in Immunology |
| ◇ | 論文タイトル | : | IL-4 dependent enhancement of human IgG production in PBL-NOG-hIL-4-Tg mice(PBL-NOG-hIL-4-Tgマウスにおけるヒトインターロイキン-4依存性ヒトIgG産生の促進) |
| ◇ | 著者 | : |
亀谷美恵1,2*, 大島志乃1, 伊藤亮治3, 大野裕介3, 山田壮我1, 星野優希1, 宮本あすか1, 鈴木(大野)舞桜1, 片野凪1, 津田万里4, 宮澤麻里子5, 柏木寛史5, 桐ケ谷大樹1, 清水智香1, 小島美香1, 菊地祐介1, 中田峻輔1, 大木廉太郎1, 安田敦6, 廣田綾子7, 中村幸男8, Jerzy K. Kulski1,9, 馬渕智生7, 石本人士5, 椎名隆1,2 1.東海大学医学部医学科基礎医学系分子生命科学 2.東海大学先進生命科学研究 3.公益財団法人実中 4.東海大学医学部付属病院診療部緩和ケア 5.東海大学医学部付属病院診療部産婦人 6.東海大学医学部付属病院診療部腎内分泌代謝内科 7.東海大学医学部付属病院診療部皮膚科 8.Repertoire Genesis株式会社 9.西オーストラリア大学バイオメディカルサイエンス部微生物免疫学教室 |
| ◇ | DOI | : | 10.3389/fimmu.2025.1670682 |
【用語説明】
*1特異的なIgG抗体:
特定の抗原に反応して作られる免疫グロブリンの一種であり、5種類あるクラス(IgM, IgD, IgG, IgA, IgE)のうちで、最も体内に広く分布しており、多くの機能を持つものである。特に体内の病原体を排除したり、臨床における免疫療法などに用いられたりするものは大部分がIgGクラスであり、最も有用であると考えられている。
*2 インターロイキン4(IL-4):
主に活性化T細胞やマスト細胞、マクロファージから産生される情報伝達物質で、比較的低分子のタンパク質である。IL-4はB細胞を活性化させて生存や増殖を促す一方、T細胞の機能を、細胞障害性の抑制やアレルギーの誘導、寄生虫の排除などにシフトさせる。
*3 ヒトB細胞:
病原体を認識し、抗体を産生して体を守る重要なリンパ球で、血液中に5~10%程度存在する。ワクチンは、病原体の感染がなくとも抗体を産生させるために、体内に類似のタンパク質などを免疫し、B細胞に抗体産生を促す方法である。
*4 クラススイッチ:
B細胞が産生する抗体である免疫グロブリンは、抗原と結合するための多様性を持つ可変領域と、他のタンパク質や細胞と連携して免疫の機能を発揮するために必要な定常領域からできている。この定常領域にはIgM, IgG, IgA,などの種類(クラス)があり、それぞれが異なる機能を発揮する。 免疫グロブリンは、最初はIgMとして産生されるが、刺激を受けると可変部は変えずにIgGあるいはIgAへと定常領域を変換する。この現象をクラススイッチという。
*5 三次リンパ組織様構造(TLS様構造):
慢性炎症が生じている組織などに、T細胞やB細胞などの免疫細胞が集積し、リンパ節に類似した構造が後天的に形成されたものを言う。ただし、典型的な濾胞構造をとって、T細胞領域やB細胞領域、濾胞樹状細胞を介した胚中心反応などが検出されることはない。この構造は局所で免疫の司令塔として機能すると考えられている。
*6 NOG-hIL-4トランスジェニックマウス:
NOGマウスは免疫不全マウスとして知られるNOD/scidマウスとIL-2受容体の共通ガンマ鎖の欠損マウスを交配することにより、極めて重度な免疫不全を呈するマウスとして開発された。NOG-hIL-4-Tgは、次世代NOGと言われるカテゴリーに属し、ヒトIL-4を全身に発現するトランスジェニックNOGマウスである。このマウスにヒトPBMCを移植するとT細胞とB細胞が生着し、GVHDを遅延できる。
*7 ヒト末梢血単核球(PBMC):
ヒト末梢血から分離される、単一の核を持つ細胞集団であり、密度勾配遠心分離にて回収される。血液中の探究およびリンパ球を主として含むが、赤血球および血小板は核がないため、また、好中球などの顆粒球は多核であるため、これらには含まれない。PBMCは、特に獲得免疫応答に必要な細胞成分を含むため、これらの研究に広く使用される。
*8 体細胞超変異(SHM):
B細胞がもつ免疫グロブリン遺伝子の可変領域が多様性を獲得する機構の一つである。抗原を認識する免疫グロブリンをもつB細胞が活性化して増殖するに従い、可変領域の遺伝子には突然変異が高頻度で生じ、抗原を認識する部分のアミノ酸配列が変化する。この中からより抗原に親和性の高い免疫グロブリンを産生するB細胞が選択されると、体内で産生される抗体の親和性が高くなる。
*9 HER2:
HER2とは、ヒト上皮成長因子受容体2の略である。正常な状態で、他の上皮成長因子受容体と結合して細胞の生存、増殖を亢進する機能を持つ。乳がんなどのがんでHER2の過剰発現が報告されており、がんの制御不能な増殖に関与していることが知られている。そのため、がん抗原として分子標的薬が開発されている。
*10 CH401MAP:
HER2分子の細胞外の一部配列を持つペプチドを8本、アミノ酸であるリジンを核として連結させた抗原である。これを免疫することにより、がん抗原であるHER2に対する抗体が産生される。
*11 BAL6MAP:
緑膿菌の外膜に発現するタンパク質複合体BAM(Beta-barrel assembly Machine)のBAL6というサブユニットの細胞外部分ペプチドを8本、アミノ酸であるリジンを核として連結させた抗原である。HER2とは配列が全く異なるため、本来同じタンパク質を認識せず、本研究では比較対象に使用している。
<研究に関するお問い合わせ>
東海大学医学部基礎医学系分子生命科学領域・亀谷美恵
TEL:0463-93-1121(ex2589)
<本件に関するお問い合わせ>
東海大学医学部付属病院 事務部事務課(広報)
TEL:0463-90-2001(直通)E-mail:prtokai@tokai.ac.jp

