ここから本文です
東海大学医学部 准教授 大塚正人を中心とする研究グループ ノックインマウス、コンディショナルノックアウトマウスを高効率に作製できる手法「Easi-CRISPR法」の実験手順を公開~現在主流の手法よりも約10倍の高効率を実現、医学生物学研究の進展に期待~
2017年12月22日
東海大学医学部 准教授 大塚 正人、同研究員 三浦 浩美、ならびに米国ネブラスカ大学の共同研究グループでは、ノックインマウス、コンディショナルノックアウトマウスを高効率に作製できる新たな手法として「Easi-CRISPR法」をすでに開発しておりましたが、このたびその詳細なプロトコル(実験手順)をまとめた論文が、12月22日(金)1時(日本時間)、英国の科学雑誌『Nature Protocols』(DOI:10.1038/nprot.2017.153 URL:http://dx.doi.org/10.1038/nprot.2017.153)に掲載され、世界に公開されました。これは、その実験手法の有効性や重要性が認められたことを意味します。
「Easi-CRISPR法」は、長鎖一本鎖DNA(ⅰ)とCRISPRリボ核タンパク質(ⅱ)をツールとして用いることで、遺伝子改変マウスの作製効率を、従来から主流となっている「CRISPRゲノム編集法(ⅲ)」に比べ、10倍以上向上させることが可能な手法です。本研究成果は、すでにオンラインジャーナル『Scientific Reports』〔2015年8 月5日〕(DOI:10.1038/srep12799)、同『Genome Biology』〔2017年5月17日〕(DOI:10.1186/s13059-017-1220-4)にて掲載されています。
■今回の論文掲載で期待されること
これまでに発表した「Easi-CRISPR法」は、既に国際マウス表現型解析コンソーシアム(IMPC)を含む国内外の多くの研究グループや研究者に使用されており、極めて再現性の高い手法であることが確認されています。また、『Scientific Reports』での最初の論文発表以降、実験手法に関する多くの質問を受けており、最近では、国際学会のワークショップにて、本手法のデモンストレーションも行いました。今回、詳細なプロトコル(実験手順)が公開されたことで、より多くの研究者が有用なモデルマウスを簡便に作製できるようになります。これは、医学生物学研究の発展につながるものであり、今後、ヒト疾患発症の分子基盤の解析や、難治性疾患の創薬研究などがこれまで以上に進展することが期待されます。
■研究の背景について
遺伝子改変マウスは、個体レベルでの遺伝子機能解析実験や疾患モデル動物として使用される極めて重要な研究ツールの一つです。中でも最も使用頻度の高いマウスは、レポーター遺伝子(ⅳ)や組換え酵素遺伝子(ⅴ)などを挿入した「ノックインマウス」、組織・時期特異的に遺伝子を破壊した「コンディショナルノックアウトマウス」であり、作製される全マウスの大半をこの二つが占めています。これらのマウスを作製するには、標的とする遺伝子座位に目的のDNA配列を挿入(ノックイン)する必要があり、最近までES細胞を介した「遺伝子ターゲティング法」によるノックインマウスの作製が主流でした。一方、この手法では時間とコスト、そして労力を要することが大きな課題となっていました。
こうした課題を受けて近年開発され、現在も主流となっている「CRISPRゲノム編集法」は、受精卵に溶液を注入するだけで、ES細胞を介することなく簡便に目的とする遺伝子改変マウスを作製することが可能な画期的な手法です。しかし、この手法では単純なノックアウトマウスは高効率で作製できる一方、ノックインマウスの作製効率は優れた技術を有する施設でも10%程度、コンディショナルノックアウトマウスでは数%程度と低く、その効率向上がテーマとなっていました。また、「CRISPRゲノム編集法」では、遺伝子をノックインする際に用いる導入DNAに一本鎖DNAを用いると効率が高くなりますが、入手可能な一本鎖DNAの長さは200塩基までであり、それ以上の長さの配列を挿入するためには二本鎖DNA(ⅵ)を用いる必要がありました。しかし、二本鎖DNAを用いた場合のノックイン効率は低く、比較的長い相同領域(ⅶ)を付加する必要があることから、ベクター(ⅷ)の作製にも労力を要するという課題があります。これまで、ノックイン効率の向上を目指し、いくつかの方法が世界中の様々な研究者によって開発されてきましたが、実用化に至る水準には達しておらず、新たな手法の確立が望まれていました。
■研究内容について
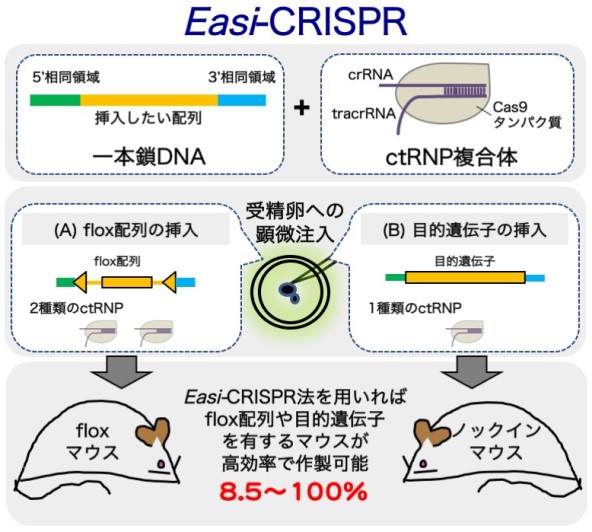
本研究グループでは、長鎖一本鎖DNAとCRISPRリボ核タンパク質を用いることで、受精卵への顕微注入を介したノックイン効率の大幅な向上に成功しました。長鎖一本鎖DNAは、挿入したいDNA配列を有するドナーDNAであり、目的DNA配列の両端に短い相同領域(50~100塩基程度)が付加されています。
本研究グループでは、長鎖一本鎖DNAを合成する方法を開発し、最大1,500塩基程度の配列を高効率にノックインする技術を確立。この技術により、ノックインマウスやコンディショナルノックアウトマウスとして使用されるfloxマウス(ⅸ)の作製に成功し、この手法を「Efficient additions with ssDNA inserts-CRISPR(Easi-CRISPR)法」と命名しました。これまでに、この手法を用いて20種類以上のfloxマウスやノックインマウスを作製することに成功しています。その遺伝子挿入効率は生まれてきたマウスのうち、floxマウスで8.5~100%、ノックインマウスで10~80%と極めて高いことが確認されています。
また、本手法では、平均40~60個の受精卵に顕微注入すれば目的のマウスが得られるのに対し、従来の手法では200~300個の受精卵が必要で、それでも目的のマウスが得られないことも多々見られました。したがって本手法は、目的のマウスの作製効率を大幅に改善したと言えます。
用語解説
(ⅰ)一本鎖DNA
通常DNAは相補的な配列を持つ二本の鎖が対合した二重らせん構造を形成していますが、片方の鎖のみであり二重らせん構造を形成していないDNAを一本鎖DNAと呼びます。
(ⅱ)CRISPRリボ核タンパク質
RNAを含む核タンパク質、すなわちリボ核酸とタンパク質の複合体をリボ核タンパク質と言います。ここでは、CRISPRゲノム編集法に用いるCas9タンパク質と短いRNA(gRNA)とを混合して調製した複合体をCRISPRリボ核タンパク質と呼びます。
(ⅲ)CRISPRゲノム編集法
細菌などが持つ適応免疫由来のシステム「CRISPR: clustered regularly interspaced short palindromic repeats」を応用した遺伝子改変技術。CRISPRの構成要素であるCas9 DNA切断酵素と、標的領域に相補的な配列を含む短いRNA(gRNAなど)を用いて、ゲノム上の任意の領域に二本鎖DNA切断を特異的に導入することができます。切断されたDNAは、細胞内に備わっているDNA修復系を用いて修復されようとしますが、その際に標的領域を自在に改変(削除、置換、挿入など)することが可能です。
(ⅳ)レポーター遺伝子
ある遺伝子の発現や活性を測定するために、それらを可視化できるようなタンパク質をコードする遺伝子をレポーター遺伝子と呼びます。オワンクラゲに由来する緑色蛍光タンパク質(GFP)などが有名です。
(ⅴ)組換え酵素遺伝子
特定のDNA配列を認識し、二つの配列間でのDNA組換え反応を触媒する酵素を組換え酵素と言い、その酵素をコードする遺伝子を組換え酵素遺伝子と呼びます。バクテリオファージP1由来の34塩基のDNA配列(loxP)を認識し、二つのloxP配列間の組換えを触媒するCreタンパク質が組換え酵素として有名です。
(ⅵ)二本鎖DNA
相補的な配列を持つ二本の鎖が対合した二重らせん構造を形成している状態のDNAです。
(ⅶ)相同領域
目的DNA配列を含むドナーDNA(導入するDNA)の両端に付加する配列で、ゲノム上の標的領域の塩基配列と同じ塩基配列を持つDNA領域です。標的領域のDNAがCRISPRによって切断された後に、ドナーDNAの両端のDNA配列と標的領域のDNA配列との相同性を利用して、目的DNA配列が標的領域に挿入されます。
(ⅷ)ベクター
目的とする遺伝子である異種DNAを宿主に運搬するDNAをベクターと言い、DNAの運び屋とも呼ばれます。ここでは、マウスに挿入したいDNA配列を大腸菌(宿主)内で増やすための環状のプラスミドDNAのことを指します。
(ⅸ)floxマウス
ノックアウト(遺伝子破壊)する標的遺伝子領域をCre組換え酵素の認識配列であるloxP配列で挟んだ遺伝子座を持つマウスです。組織特異的にCre酵素を発現するマウスと掛け合わせて、組織・時期特異的に目的遺伝子が破壊されたコンディショナルノックアウトマウスとして利用されます。
■本件に関するお問い合わせ
学校法人東海大学 経営企画室広報課
TEL:03-3467-2211(代表)
FAX:03-3485-4939
mail:pr@tokai.ac.jp
「Easi-CRISPR法」は、長鎖一本鎖DNA(ⅰ)とCRISPRリボ核タンパク質(ⅱ)をツールとして用いることで、遺伝子改変マウスの作製効率を、従来から主流となっている「CRISPRゲノム編集法(ⅲ)」に比べ、10倍以上向上させることが可能な手法です。本研究成果は、すでにオンラインジャーナル『Scientific Reports』〔2015年8 月5日〕(DOI:10.1038/srep12799)、同『Genome Biology』〔2017年5月17日〕(DOI:10.1186/s13059-017-1220-4)にて掲載されています。
■今回の論文掲載で期待されること
これまでに発表した「Easi-CRISPR法」は、既に国際マウス表現型解析コンソーシアム(IMPC)を含む国内外の多くの研究グループや研究者に使用されており、極めて再現性の高い手法であることが確認されています。また、『Scientific Reports』での最初の論文発表以降、実験手法に関する多くの質問を受けており、最近では、国際学会のワークショップにて、本手法のデモンストレーションも行いました。今回、詳細なプロトコル(実験手順)が公開されたことで、より多くの研究者が有用なモデルマウスを簡便に作製できるようになります。これは、医学生物学研究の発展につながるものであり、今後、ヒト疾患発症の分子基盤の解析や、難治性疾患の創薬研究などがこれまで以上に進展することが期待されます。
■研究の背景について
遺伝子改変マウスは、個体レベルでの遺伝子機能解析実験や疾患モデル動物として使用される極めて重要な研究ツールの一つです。中でも最も使用頻度の高いマウスは、レポーター遺伝子(ⅳ)や組換え酵素遺伝子(ⅴ)などを挿入した「ノックインマウス」、組織・時期特異的に遺伝子を破壊した「コンディショナルノックアウトマウス」であり、作製される全マウスの大半をこの二つが占めています。これらのマウスを作製するには、標的とする遺伝子座位に目的のDNA配列を挿入(ノックイン)する必要があり、最近までES細胞を介した「遺伝子ターゲティング法」によるノックインマウスの作製が主流でした。一方、この手法では時間とコスト、そして労力を要することが大きな課題となっていました。
こうした課題を受けて近年開発され、現在も主流となっている「CRISPRゲノム編集法」は、受精卵に溶液を注入するだけで、ES細胞を介することなく簡便に目的とする遺伝子改変マウスを作製することが可能な画期的な手法です。しかし、この手法では単純なノックアウトマウスは高効率で作製できる一方、ノックインマウスの作製効率は優れた技術を有する施設でも10%程度、コンディショナルノックアウトマウスでは数%程度と低く、その効率向上がテーマとなっていました。また、「CRISPRゲノム編集法」では、遺伝子をノックインする際に用いる導入DNAに一本鎖DNAを用いると効率が高くなりますが、入手可能な一本鎖DNAの長さは200塩基までであり、それ以上の長さの配列を挿入するためには二本鎖DNA(ⅵ)を用いる必要がありました。しかし、二本鎖DNAを用いた場合のノックイン効率は低く、比較的長い相同領域(ⅶ)を付加する必要があることから、ベクター(ⅷ)の作製にも労力を要するという課題があります。これまで、ノックイン効率の向上を目指し、いくつかの方法が世界中の様々な研究者によって開発されてきましたが、実用化に至る水準には達しておらず、新たな手法の確立が望まれていました。
■研究内容について
本研究グループでは、長鎖一本鎖DNAとCRISPRリボ核タンパク質を用いることで、受精卵への顕微注入を介したノックイン効率の大幅な向上に成功しました。長鎖一本鎖DNAは、挿入したいDNA配列を有するドナーDNAであり、目的DNA配列の両端に短い相同領域(50~100塩基程度)が付加されています。
本研究グループでは、長鎖一本鎖DNAを合成する方法を開発し、最大1,500塩基程度の配列を高効率にノックインする技術を確立。この技術により、ノックインマウスやコンディショナルノックアウトマウスとして使用されるfloxマウス(ⅸ)の作製に成功し、この手法を「Efficient additions with ssDNA inserts-CRISPR(Easi-CRISPR)法」と命名しました。これまでに、この手法を用いて20種類以上のfloxマウスやノックインマウスを作製することに成功しています。その遺伝子挿入効率は生まれてきたマウスのうち、floxマウスで8.5~100%、ノックインマウスで10~80%と極めて高いことが確認されています。
また、本手法では、平均40~60個の受精卵に顕微注入すれば目的のマウスが得られるのに対し、従来の手法では200~300個の受精卵が必要で、それでも目的のマウスが得られないことも多々見られました。したがって本手法は、目的のマウスの作製効率を大幅に改善したと言えます。
用語解説
(ⅰ)一本鎖DNA
通常DNAは相補的な配列を持つ二本の鎖が対合した二重らせん構造を形成していますが、片方の鎖のみであり二重らせん構造を形成していないDNAを一本鎖DNAと呼びます。
(ⅱ)CRISPRリボ核タンパク質
RNAを含む核タンパク質、すなわちリボ核酸とタンパク質の複合体をリボ核タンパク質と言います。ここでは、CRISPRゲノム編集法に用いるCas9タンパク質と短いRNA(gRNA)とを混合して調製した複合体をCRISPRリボ核タンパク質と呼びます。
(ⅲ)CRISPRゲノム編集法
細菌などが持つ適応免疫由来のシステム「CRISPR: clustered regularly interspaced short palindromic repeats」を応用した遺伝子改変技術。CRISPRの構成要素であるCas9 DNA切断酵素と、標的領域に相補的な配列を含む短いRNA(gRNAなど)を用いて、ゲノム上の任意の領域に二本鎖DNA切断を特異的に導入することができます。切断されたDNAは、細胞内に備わっているDNA修復系を用いて修復されようとしますが、その際に標的領域を自在に改変(削除、置換、挿入など)することが可能です。
(ⅳ)レポーター遺伝子
ある遺伝子の発現や活性を測定するために、それらを可視化できるようなタンパク質をコードする遺伝子をレポーター遺伝子と呼びます。オワンクラゲに由来する緑色蛍光タンパク質(GFP)などが有名です。
(ⅴ)組換え酵素遺伝子
特定のDNA配列を認識し、二つの配列間でのDNA組換え反応を触媒する酵素を組換え酵素と言い、その酵素をコードする遺伝子を組換え酵素遺伝子と呼びます。バクテリオファージP1由来の34塩基のDNA配列(loxP)を認識し、二つのloxP配列間の組換えを触媒するCreタンパク質が組換え酵素として有名です。
(ⅵ)二本鎖DNA
相補的な配列を持つ二本の鎖が対合した二重らせん構造を形成している状態のDNAです。
(ⅶ)相同領域
目的DNA配列を含むドナーDNA(導入するDNA)の両端に付加する配列で、ゲノム上の標的領域の塩基配列と同じ塩基配列を持つDNA領域です。標的領域のDNAがCRISPRによって切断された後に、ドナーDNAの両端のDNA配列と標的領域のDNA配列との相同性を利用して、目的DNA配列が標的領域に挿入されます。
(ⅷ)ベクター
目的とする遺伝子である異種DNAを宿主に運搬するDNAをベクターと言い、DNAの運び屋とも呼ばれます。ここでは、マウスに挿入したいDNA配列を大腸菌(宿主)内で増やすための環状のプラスミドDNAのことを指します。
(ⅸ)floxマウス
ノックアウト(遺伝子破壊)する標的遺伝子領域をCre組換え酵素の認識配列であるloxP配列で挟んだ遺伝子座を持つマウスです。組織特異的にCre酵素を発現するマウスと掛け合わせて、組織・時期特異的に目的遺伝子が破壊されたコンディショナルノックアウトマウスとして利用されます。
■本件に関するお問い合わせ
学校法人東海大学 経営企画室広報課
TEL:03-3467-2211(代表)
FAX:03-3485-4939
mail:pr@tokai.ac.jp

