ここから本文です
国内初となる体外放射線照射による難治性致死性心室不整脈の治療を実施 ~薬剤、カテーテルアブレーション、植込み型除細動器に次ぐ第4の治療法として期待~
2021年04月13日
東海大学医学部付属病院 循環器内科 教授の吉岡公一郎の研究グループは放射線治療科 客員教授の国枝悦夫らと共に、国内初となる体外放射線照射による難治性致死性心室不整脈(心室頻拍)〔ⅰ〕の治療 (特定臨床研究, 厚労省認定番号 jRCTs032190041, https://rctportal.niph.go.jp/detail/jr?trial_id=jRCTs032190041)を2019年11月に実施しました。治療から1年4カ月余が経過しましたが、合併症は認められず良好な経過をたどっています。その治療内容をまとめた論文が、2021年2月12日『Heart Rhythm Case Reports』にオンライン掲載されました。
<本件のポイント>
①東海大学医学部付属病院において、心室頻拍に対する国内初の体外放射線による不整脈治療を実施しました。
②痛みは伴わず、治療時間は準備を含め1時間以内(照射時間4分)と低侵襲です。
③心室頻拍に対する体外放射線治療は、従来治療に抵抗性の不整脈治療に対して次なる選択肢として期待されます。
④これまで放射線治療は主に腫瘍のみを対象としていましたが、全く異なる不整脈治療への応用は革新的なことであり、既存の医療機器を用いた新たな対象疾患への可能性を広げます。
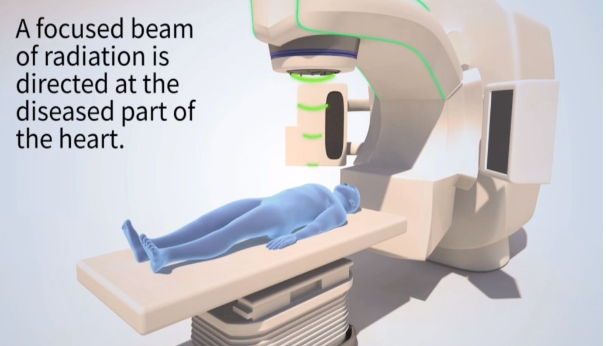
■体外放射線照射による心室頻拍治療の開始
がん治療では、体幹部定位放射線治療(SBRT)〔ⅱ〕などの放射線治療技術の進歩により、標的組織に隣接する正常臓器への障害を最小限に抑えつつ、標的に対して高線量の放射線を正確に照射することが可能となりました。
近年、この技法を応用する動きが広がっており、米国・ワシントン大学では2017年より、「難治性致死性心室不整脈(心室頻拍)」に対してこの技法を応用した新しい治療法を実施しています。「X線を体外から照射して不整脈基質をわずか15分で焼灼する」という新しい治療法とその成果は、当時の循環器領域のトップニュースとなりました (Cuculich PS, et al. NEJM, 2017)。
■当院での治療実施について
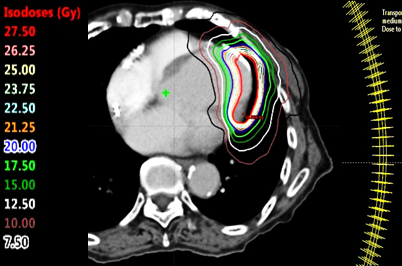
東海大学医学部付属病院循環器内科と同放射線治療科の合同研究グループは、国内の医療機関において初めて本治療を実施すべく、ワシントン大学でのハンズオントレーニングおよび具体的な治療手順の指導を受け、時間をかけて準備を進めてきました。さらに、当院の画像診断科と連携し、独自に心臓核医学(I-123-MIBG、F-18-FDG-PET)〔ⅲ〕による機能評価手法を取り入れて、綿密な照射計画を作成しました。 その上で、安全性を第一に協議を重ねた結果、2019 年11月、日本人で第1例目となるSBRT(X線)による不整脈治療を実施しました。現時点で実施から1年4カ月余が経過しましたが、当該患者さんに合併症は認められず、良好な不整脈抑制効果が得られました。高時間分解能ホルター心電図を用いた解析では、照射後に心臓の伝導性を反映する心室遅延電位の改善と迷走神経活動の回復が認められています。放射線による晩期心臓障害の可能性についても十分に配慮して、継続観察しています。
当院循環器内科専門外来においては、従来治療に難渋する心室頻拍の治療以外にも、肺がん・食道がん・乳がんなど胸部悪性腫瘍に対する放射線治療にて、放射線心臓障害が懸念される症例の冠動脈疾患や不整脈の発生に関するリスク管理も行っています。
■本研究で期待されること
致死性心室不整脈とは、治療に緊急を要する危険な不整脈を指します。心室頻拍では、心臓が1分間に120回以上不規則に痙攣し、ときに心室細動へ移行し突然死の原因となります。心室頻拍を引き起こす可能性のある代表的な器質的心臓病としては、心筋梗塞、拡張型心筋症、肥大型心筋症、催不整脈性右室心筋症、心サルコイドーシスなどがあります。日本では年間6~8 万人が心臓突然死で亡くなっており、高齢社会においてさらに増加することが予想されています。
心室頻拍の治療は、現在のところ薬剤、カテーテルアブレーション〔ⅳ〕、植込み型除細動器〔ⅴ〕の3つが主体ですが、これらを組み合わせて治療を行っても難渋することのある重篤な疾患です。あるいはいくつかの理由でこうした治療を全て受けられないことも少なくありません。体外放射線治療は、心室頻拍に対する第4の選択肢として期待されます。現時点では心筋梗塞に合併する心室頻拍が良い適応ですが、世界的にはその他の疾患についても僅かずつ治療が開始されてきました。
患者さんにとってのメリットは、無痛治療のため麻酔の必要がなく、また照射時間が極めて短時間であることから治療侵襲性が低いことです。これまでの放射線治療の適応は、ほぼ腫瘍疾患に限られていましたが、不整脈といったまったく異なる疾患領域への治療応用は極めて革新的であると考えています。
■今までの研究経過と今後の課題
放射線が不整脈治療において有効に働くメカニズムは、現段階では十分には明らかになっていません。ワシントン大学では、“カテーテルアブレーションのかわりに放射線を用いて不整脈基質の焼灼を行うことで心筋の線維化を形成し、不整脈発生の原因となる異常な電気回路を物理的に遮断する”というコンセプトから始まりました。ところが治療早期(1か月以内)より不整脈の抑制作用が高率に認められる事実から、その効果は必ずしも線維化に起因しないことを述べています。心筋線維化の完成には3か月を要するため、その他の放射線生物学的影響による抗不整脈効果があると想定されたのです。
本研究グループは世界に先駆けて1997年から、放射線(重粒子線)〔ⅵ〕が心臓に及ぼす電気生理学的機序について基礎研究を重ねてきました。国立研究開発法人 量子科学技術研究開発機構 放射線医学総合研究所との共同研究により、2000年の米国心臓協会学術集会(AHA)において「放射線が有する抗不整脈効果について」はじめて明らかにました。その主要なメカニズムとして、重粒子線が梗塞心における心臓ギャップ結合蛋白コネキシン43(Cx43)の発現を促す事実を発見し、その結果として興奮伝導の回復が促されることを論文報告しています(Cardiovasc Res. 2006, Am J Physiol Heart Circ Physio. 2010, Pacing Clin Electrophysiol. 2017, Int J Part Ther. 2018)。
コネキシン蛋白は細胞間コミュニケーションを司る重要な役割を担っていますが、不全心で著しく減少することから、不整脈発生の要因として知られてきました。そのため心筋Cx43を増加させるための薬剤開発や遺伝子導入などの研究が数多く実施されてきた経緯があります。それゆえ、重粒子線を5分間、1回だけ心臓左室へ照射することで得られたCx43の発現亢進は、2006年当時驚きを持って受けとめられました。以来われわれは、“放射線を用いて不整脈基質を焼灼する”といったコンセプトではなく、“機能低下した心筋のギャップ結合を回復させることで不整脈基質を制御する”という観点で研究を進めています。
現在、重粒子以外にX線についても同様の効果を得られるか基礎実験を施行しています。X線による放射線治療機器は全国に普及していることから、より詳細なメカニズムが明らかになることで、不整脈に苦しむ患者さんに対して本治療を幅広く提供出来るからです。いっぽう重粒子線においては、その物理学的特性からX線よりも心臓周辺臓器の照射線量を抑えることが可能です。両者の特徴を使い分け、放射性臓器障害を最小限に留めつつ、最大効果を得ることを目的としデータを蓄積中です。
■特記事項
上記研究は以下の支援により行われています。日本学術振興会 科学研究費助成事業 基盤研究C 「致死性心室不整脈患者に対する放射線体外照射による新規不整脈治療」(研究代表者 吉岡公一郎、2020-2023)、 日本学術振興会 科学研究費助成事業 基盤研究C「病態ウサギにおける重粒子線の心房細動抑制作用と電気生理学機序の解明」(研究代表者 網野真理, 2019-2022)、東海大学医学部医学科研究助成金重点的研究「ウサギ心房細動モデルにおける炭素線照射による抗不整脈効果のメカニズム解析」(研究代表者 網野真理, 2020-2021)、QST 戦略的理事長ファンド(研究分担者 網野真理、 2020-2021)、公益財団法人 放射線影響協会 研究奨励助成金「放射線体外照射による致死性心室不整脈抑制作用における交感神経除神経効果を明らかにする」(研究代表者 網野真理, 2020-2021)。
【掲載論文】
雑誌名 :Heart Rhythm Case Reports (オンライン版 2021年2月12日)
タイトル :Analysis of depolarization abnormality and autonomic nerve function after stereotactic body radiation therapy for ventricular tachycardia in a patient with old myocardial infarction
著者 :Mari Amino, MD, PhD, Shigeto Kabuki, PhD, Etsuo Kunieda, MD, PhD, Atsuhiko Yagishita, MD, PhD, Yuji Ikari, MD, PhD, Koichiro Yoshioka, MD, PhD, FHRS
URL :https://doi.org/10.1016/j.hrcr.2021.01.023
DOI :10.1016/j.hrcr.2021.01.023
【研究責任者】
吉岡公一郎(東海大学医学部付属病院循環器内科 教授、量子科学技術研究開発機構 共同利用研究員)
【研究分担者】
国枝悦夫(東海大学医学部付属病院 放射線治療科 客員教授、総合東京病院放射線治療センター長)
網野真理(東海大学医学部付属病院 循環器内科 准教授、量子科学技術研究開発機構 重粒子線治療研究部 主幹研究員)
株木重人(東海大学医学部付属病院 放射線治療科 講師)
橋本順 (東海大学医学部付属病院 画像診断科 教授)
伊苅裕二(東海大学医学部付属病院 循環器内科 教授)
菅原章友(東海大学医学部付属病院 放射線治療科 教授)
柳下敦彦(東海大学医学部付属病院 循環器内科 准教授)
【コーディネーター】
藤原由希子(東海大学医学部付属病院 治験・臨床研究センター Ns CRC)
用語解説
〔ⅰ〕 難治性致死性心室不整脈
放置すると短時間で死亡してしまう危険性の高い不整脈を「致死性不整脈」と呼び、極めて重症度が高い病態です。頻脈性(脈が速い)と徐脈性(脈が遅い)に大別され、前者では心室細動および持続性心室頻拍、後者では洞停止および完全房室ブロックが代表的な疾患です。心室頻拍の治療においては、従来治療(薬剤、カテーテルアブレーション、植込み型除細動器など)に抵抗性の場合を難治性と定義します。薬剤副作用で投薬を中断せざるを得ない場合や、解剖学的理由などでアブレーション治療を施せない場合も含まれます。
〔ⅱ〕 体幹部定位放射線治療(SBRT)
放射線技術の開発によって三次元高精度照射が可能となり、胸部や腹部の病巣に対して放射線を6~8方向から1点に高い精度で照射する治療法です。集中性に優れていることから「ピンポイント照射」とも呼ばれています。1回線量を高く設定することが出来るため、患者さんは短期間で治療を終えることが可能です。
〔ⅲ〕 心臓核医学(I-123-MIBG, F-18-FDG-PET)
I-123-MIBG (123I- metaiodobenzylguanidine scintigraphy):不整脈の発生は心臓交感神経の影響を強く受けることから、MIBGを用いて心筋局所における交感神経機能を評価します。MIBGはノルアドレナリンと構造が類似していることから、心筋内でノルアドレナリンと同様の挙動を示します。交感神経末端において心筋に取り込まれ、貯蔵顆粒に保存されます。正常心筋ではMIBGの高い集積がみられますが、いっぽう障害心筋では交感神経機能の障害をきたしていることから、除神経領域ではMIBGが集積しないという現象が画像で確認できます。
F-18-FDG-PET (Fluorodeoxyglucose F18 Positron Emission Tomography):PET検査は一般的に“がん疾患”で多用されることが多い検査です。循環器領域では、虚血性心筋症による心不全患者を対象に、心筋血流SPECTでは生存心筋の判定が困難な場合にPET検査を施行します。PETはSPECTに比べて、ガンマ線の吸収による減衰が少なく、鮮明な画像が得られることが特徴です。心筋の血液かん流が、僅かながら温存されている部位を同定することが可能です。
〔ⅳ〕 カテーテルアブレーション
カテーテルと呼ばれる直径2mm程度の細い管を鼠径部の大腿静脈から心臓に挿入し、不整脈の原因となる異常な電気回路を熱焼灼して、異常な電気回路を遮断する根治治療法です。外科的な心臓手術と違って、胸部を切開する必要はありません。カテーテルアブレーションで様々な不整脈を治療することができますが、不整脈の種類や患者さんの状態によって根治率や再発率は異なり、複数回の治療が必要な場合もあります。
〔ⅴ〕 植込み型除細動器
植込み型除細動器は、致死性頻脈性心室不整脈(心室頻拍、心室細動など)の発生を検知するために、心臓を常時監視し、発作時には電気ショックを作動させて突然死を予防します。しかし不整脈が起こらないよう予防する機器ではないため、根治治療にはなり得ません。薬物やカテーテルアブレーション治療などと併用することが効果的と言われています。一般的にICD(Implantable Cardioverter Defibrillator)と呼ばれています。電池の寿命は作動状況によって異なりますが、大体4~5年程度で電池交換手術が必要となります。
〔ⅵ〕 重粒子線
重粒子とはヘリウム(He)より重い原子番号をもつ原子の原子核(重イオン)ビームを指します。日本では重粒子線の一つである炭素線が代表的で、20年近くにわたり“がん治療”に用いられていることから、「重粒子線」イコール「炭素線」と考えても良いでしょう。陽子の12倍の重さをもつ炭素の原子核を光速の約70%まで加速して照射するため、高い線量集中性と生物効果を持ち合わせ、“がん治療”に適した性質と言えます。国立研究開発法人 量子科学技術研究開発機構 QST病院 (旧 放射線医学総合研究所病院)は、重粒子線を用いた“がん治療”を世界で最も早く開始し、その実績は他国の追随を許しません(https://www.nirs.qst.go.jp/hospital/)。我が国は世界屈指の重粒子線治療先進国です。
■本件に関するお問い合わせ
東海大学医学部付属病院 循環器内科 担当:吉岡公一郎
TEL.0463-93-1121(代表)
E-mail:ko1@is.icc.u-tokai.ac.jp
<本件のポイント>
①東海大学医学部付属病院において、心室頻拍に対する国内初の体外放射線による不整脈治療を実施しました。
②痛みは伴わず、治療時間は準備を含め1時間以内(照射時間4分)と低侵襲です。
③心室頻拍に対する体外放射線治療は、従来治療に抵抗性の不整脈治療に対して次なる選択肢として期待されます。
④これまで放射線治療は主に腫瘍のみを対象としていましたが、全く異なる不整脈治療への応用は革新的なことであり、既存の医療機器を用いた新たな対象疾患への可能性を広げます。
■体外放射線照射による心室頻拍治療の開始
がん治療では、体幹部定位放射線治療(SBRT)〔ⅱ〕などの放射線治療技術の進歩により、標的組織に隣接する正常臓器への障害を最小限に抑えつつ、標的に対して高線量の放射線を正確に照射することが可能となりました。
近年、この技法を応用する動きが広がっており、米国・ワシントン大学では2017年より、「難治性致死性心室不整脈(心室頻拍)」に対してこの技法を応用した新しい治療法を実施しています。「X線を体外から照射して不整脈基質をわずか15分で焼灼する」という新しい治療法とその成果は、当時の循環器領域のトップニュースとなりました (Cuculich PS, et al. NEJM, 2017)。
■当院での治療実施について
東海大学医学部付属病院循環器内科と同放射線治療科の合同研究グループは、国内の医療機関において初めて本治療を実施すべく、ワシントン大学でのハンズオントレーニングおよび具体的な治療手順の指導を受け、時間をかけて準備を進めてきました。さらに、当院の画像診断科と連携し、独自に心臓核医学(I-123-MIBG、F-18-FDG-PET)〔ⅲ〕による機能評価手法を取り入れて、綿密な照射計画を作成しました。 その上で、安全性を第一に協議を重ねた結果、2019 年11月、日本人で第1例目となるSBRT(X線)による不整脈治療を実施しました。現時点で実施から1年4カ月余が経過しましたが、当該患者さんに合併症は認められず、良好な不整脈抑制効果が得られました。高時間分解能ホルター心電図を用いた解析では、照射後に心臓の伝導性を反映する心室遅延電位の改善と迷走神経活動の回復が認められています。放射線による晩期心臓障害の可能性についても十分に配慮して、継続観察しています。
当院循環器内科専門外来においては、従来治療に難渋する心室頻拍の治療以外にも、肺がん・食道がん・乳がんなど胸部悪性腫瘍に対する放射線治療にて、放射線心臓障害が懸念される症例の冠動脈疾患や不整脈の発生に関するリスク管理も行っています。
■本研究で期待されること
致死性心室不整脈とは、治療に緊急を要する危険な不整脈を指します。心室頻拍では、心臓が1分間に120回以上不規則に痙攣し、ときに心室細動へ移行し突然死の原因となります。心室頻拍を引き起こす可能性のある代表的な器質的心臓病としては、心筋梗塞、拡張型心筋症、肥大型心筋症、催不整脈性右室心筋症、心サルコイドーシスなどがあります。日本では年間6~8 万人が心臓突然死で亡くなっており、高齢社会においてさらに増加することが予想されています。
心室頻拍の治療は、現在のところ薬剤、カテーテルアブレーション〔ⅳ〕、植込み型除細動器〔ⅴ〕の3つが主体ですが、これらを組み合わせて治療を行っても難渋することのある重篤な疾患です。あるいはいくつかの理由でこうした治療を全て受けられないことも少なくありません。体外放射線治療は、心室頻拍に対する第4の選択肢として期待されます。現時点では心筋梗塞に合併する心室頻拍が良い適応ですが、世界的にはその他の疾患についても僅かずつ治療が開始されてきました。
患者さんにとってのメリットは、無痛治療のため麻酔の必要がなく、また照射時間が極めて短時間であることから治療侵襲性が低いことです。これまでの放射線治療の適応は、ほぼ腫瘍疾患に限られていましたが、不整脈といったまったく異なる疾患領域への治療応用は極めて革新的であると考えています。
■今までの研究経過と今後の課題
放射線が不整脈治療において有効に働くメカニズムは、現段階では十分には明らかになっていません。ワシントン大学では、“カテーテルアブレーションのかわりに放射線を用いて不整脈基質の焼灼を行うことで心筋の線維化を形成し、不整脈発生の原因となる異常な電気回路を物理的に遮断する”というコンセプトから始まりました。ところが治療早期(1か月以内)より不整脈の抑制作用が高率に認められる事実から、その効果は必ずしも線維化に起因しないことを述べています。心筋線維化の完成には3か月を要するため、その他の放射線生物学的影響による抗不整脈効果があると想定されたのです。
本研究グループは世界に先駆けて1997年から、放射線(重粒子線)〔ⅵ〕が心臓に及ぼす電気生理学的機序について基礎研究を重ねてきました。国立研究開発法人 量子科学技術研究開発機構 放射線医学総合研究所との共同研究により、2000年の米国心臓協会学術集会(AHA)において「放射線が有する抗不整脈効果について」はじめて明らかにました。その主要なメカニズムとして、重粒子線が梗塞心における心臓ギャップ結合蛋白コネキシン43(Cx43)の発現を促す事実を発見し、その結果として興奮伝導の回復が促されることを論文報告しています(Cardiovasc Res. 2006, Am J Physiol Heart Circ Physio. 2010, Pacing Clin Electrophysiol. 2017, Int J Part Ther. 2018)。
コネキシン蛋白は細胞間コミュニケーションを司る重要な役割を担っていますが、不全心で著しく減少することから、不整脈発生の要因として知られてきました。そのため心筋Cx43を増加させるための薬剤開発や遺伝子導入などの研究が数多く実施されてきた経緯があります。それゆえ、重粒子線を5分間、1回だけ心臓左室へ照射することで得られたCx43の発現亢進は、2006年当時驚きを持って受けとめられました。以来われわれは、“放射線を用いて不整脈基質を焼灼する”といったコンセプトではなく、“機能低下した心筋のギャップ結合を回復させることで不整脈基質を制御する”という観点で研究を進めています。
現在、重粒子以外にX線についても同様の効果を得られるか基礎実験を施行しています。X線による放射線治療機器は全国に普及していることから、より詳細なメカニズムが明らかになることで、不整脈に苦しむ患者さんに対して本治療を幅広く提供出来るからです。いっぽう重粒子線においては、その物理学的特性からX線よりも心臓周辺臓器の照射線量を抑えることが可能です。両者の特徴を使い分け、放射性臓器障害を最小限に留めつつ、最大効果を得ることを目的としデータを蓄積中です。
■特記事項
上記研究は以下の支援により行われています。日本学術振興会 科学研究費助成事業 基盤研究C 「致死性心室不整脈患者に対する放射線体外照射による新規不整脈治療」(研究代表者 吉岡公一郎、2020-2023)、 日本学術振興会 科学研究費助成事業 基盤研究C「病態ウサギにおける重粒子線の心房細動抑制作用と電気生理学機序の解明」(研究代表者 網野真理, 2019-2022)、東海大学医学部医学科研究助成金重点的研究「ウサギ心房細動モデルにおける炭素線照射による抗不整脈効果のメカニズム解析」(研究代表者 網野真理, 2020-2021)、QST 戦略的理事長ファンド(研究分担者 網野真理、 2020-2021)、公益財団法人 放射線影響協会 研究奨励助成金「放射線体外照射による致死性心室不整脈抑制作用における交感神経除神経効果を明らかにする」(研究代表者 網野真理, 2020-2021)。
【掲載論文】
雑誌名 :Heart Rhythm Case Reports (オンライン版 2021年2月12日)
タイトル :Analysis of depolarization abnormality and autonomic nerve function after stereotactic body radiation therapy for ventricular tachycardia in a patient with old myocardial infarction
著者 :Mari Amino, MD, PhD, Shigeto Kabuki, PhD, Etsuo Kunieda, MD, PhD, Atsuhiko Yagishita, MD, PhD, Yuji Ikari, MD, PhD, Koichiro Yoshioka, MD, PhD, FHRS
URL :https://doi.org/10.1016/j.hrcr.2021.01.023
DOI :10.1016/j.hrcr.2021.01.023
【研究責任者】
吉岡公一郎(東海大学医学部付属病院循環器内科 教授、量子科学技術研究開発機構 共同利用研究員)
【研究分担者】
国枝悦夫(東海大学医学部付属病院 放射線治療科 客員教授、総合東京病院放射線治療センター長)
網野真理(東海大学医学部付属病院 循環器内科 准教授、量子科学技術研究開発機構 重粒子線治療研究部 主幹研究員)
株木重人(東海大学医学部付属病院 放射線治療科 講師)
橋本順 (東海大学医学部付属病院 画像診断科 教授)
伊苅裕二(東海大学医学部付属病院 循環器内科 教授)
菅原章友(東海大学医学部付属病院 放射線治療科 教授)
柳下敦彦(東海大学医学部付属病院 循環器内科 准教授)
【コーディネーター】
藤原由希子(東海大学医学部付属病院 治験・臨床研究センター Ns CRC)
用語解説
〔ⅰ〕 難治性致死性心室不整脈
放置すると短時間で死亡してしまう危険性の高い不整脈を「致死性不整脈」と呼び、極めて重症度が高い病態です。頻脈性(脈が速い)と徐脈性(脈が遅い)に大別され、前者では心室細動および持続性心室頻拍、後者では洞停止および完全房室ブロックが代表的な疾患です。心室頻拍の治療においては、従来治療(薬剤、カテーテルアブレーション、植込み型除細動器など)に抵抗性の場合を難治性と定義します。薬剤副作用で投薬を中断せざるを得ない場合や、解剖学的理由などでアブレーション治療を施せない場合も含まれます。
〔ⅱ〕 体幹部定位放射線治療(SBRT)
放射線技術の開発によって三次元高精度照射が可能となり、胸部や腹部の病巣に対して放射線を6~8方向から1点に高い精度で照射する治療法です。集中性に優れていることから「ピンポイント照射」とも呼ばれています。1回線量を高く設定することが出来るため、患者さんは短期間で治療を終えることが可能です。
〔ⅲ〕 心臓核医学(I-123-MIBG, F-18-FDG-PET)
I-123-MIBG (123I- metaiodobenzylguanidine scintigraphy):不整脈の発生は心臓交感神経の影響を強く受けることから、MIBGを用いて心筋局所における交感神経機能を評価します。MIBGはノルアドレナリンと構造が類似していることから、心筋内でノルアドレナリンと同様の挙動を示します。交感神経末端において心筋に取り込まれ、貯蔵顆粒に保存されます。正常心筋ではMIBGの高い集積がみられますが、いっぽう障害心筋では交感神経機能の障害をきたしていることから、除神経領域ではMIBGが集積しないという現象が画像で確認できます。
F-18-FDG-PET (Fluorodeoxyglucose F18 Positron Emission Tomography):PET検査は一般的に“がん疾患”で多用されることが多い検査です。循環器領域では、虚血性心筋症による心不全患者を対象に、心筋血流SPECTでは生存心筋の判定が困難な場合にPET検査を施行します。PETはSPECTに比べて、ガンマ線の吸収による減衰が少なく、鮮明な画像が得られることが特徴です。心筋の血液かん流が、僅かながら温存されている部位を同定することが可能です。
〔ⅳ〕 カテーテルアブレーション
カテーテルと呼ばれる直径2mm程度の細い管を鼠径部の大腿静脈から心臓に挿入し、不整脈の原因となる異常な電気回路を熱焼灼して、異常な電気回路を遮断する根治治療法です。外科的な心臓手術と違って、胸部を切開する必要はありません。カテーテルアブレーションで様々な不整脈を治療することができますが、不整脈の種類や患者さんの状態によって根治率や再発率は異なり、複数回の治療が必要な場合もあります。
〔ⅴ〕 植込み型除細動器
植込み型除細動器は、致死性頻脈性心室不整脈(心室頻拍、心室細動など)の発生を検知するために、心臓を常時監視し、発作時には電気ショックを作動させて突然死を予防します。しかし不整脈が起こらないよう予防する機器ではないため、根治治療にはなり得ません。薬物やカテーテルアブレーション治療などと併用することが効果的と言われています。一般的にICD(Implantable Cardioverter Defibrillator)と呼ばれています。電池の寿命は作動状況によって異なりますが、大体4~5年程度で電池交換手術が必要となります。
〔ⅵ〕 重粒子線
重粒子とはヘリウム(He)より重い原子番号をもつ原子の原子核(重イオン)ビームを指します。日本では重粒子線の一つである炭素線が代表的で、20年近くにわたり“がん治療”に用いられていることから、「重粒子線」イコール「炭素線」と考えても良いでしょう。陽子の12倍の重さをもつ炭素の原子核を光速の約70%まで加速して照射するため、高い線量集中性と生物効果を持ち合わせ、“がん治療”に適した性質と言えます。国立研究開発法人 量子科学技術研究開発機構 QST病院 (旧 放射線医学総合研究所病院)は、重粒子線を用いた“がん治療”を世界で最も早く開始し、その実績は他国の追随を許しません(https://www.nirs.qst.go.jp/hospital/)。我が国は世界屈指の重粒子線治療先進国です。
■本件に関するお問い合わせ
東海大学医学部付属病院 循環器内科 担当:吉岡公一郎
TEL.0463-93-1121(代表)
E-mail:ko1@is.icc.u-tokai.ac.jp